RDC结构组成
从RDC的结构来看,RDC包括靶向配体、连接子、螯合剂和放射性核素,各组成部分相互配合,共同发挥作用。其中,靶向配体是实现精准定位的关键部分,连接子负责连接靶向配体和螯合剂,螯合剂用于稳定螯合放射性核素,而放射性核素通过在肿瘤细胞处发射能量,用于治疗或诊断。

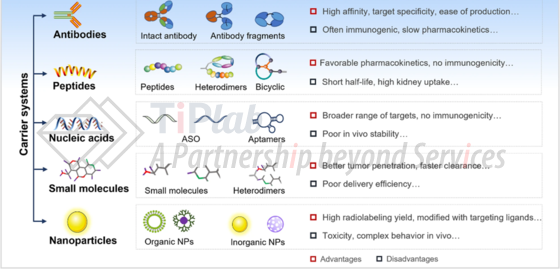
对于靶向配体,靶向治疗领域内的研究人员已能制备和开发多种针对不同靶点的靶向配体。常见的靶向配体有抗体类配体、核酸类配体、多肽类配体或小分子类配体等,不同种类的靶向配体在用于RDC时具有不同的特点,例如:
(1)抗体类配体具有较好的亲和力和特异性,但全长的抗体分子由于分子量较高,药代动力学缓慢,且较难穿透肿瘤细胞,在实体瘤内扩散率较低。由抗体衍生的抗原结合片段(纳米抗体、单链抗体等)的分子量小,但稳定性低于抗体。
(2)核酸类配体(例如反义寡核苷酸(ASO)等)靶点范围更广,免疫原性较低,但体内稳定性较低。
(3)多肽类配体具有较好的亲和力和特异性结合能力,且分子量低,组织穿透能力强,但半衰期较短,肾脏摄取率较高。
对于放射性核素,根据诊断和治疗的不同用途,可选择诊断型核素或治疗型核素。诊断型核素可以是发射正电子的核素,如镓(68Ga),可以是发射γ射线的核素,如锝(99mTc)、镓(67Ga)等。治疗型核素可以是发射α射线的核素,如铍(223Ra)、锕(225Ac)等,可以是发射β射线的核素,如镥(177Lu)、钇(90Y)、锶(90Sr)等。
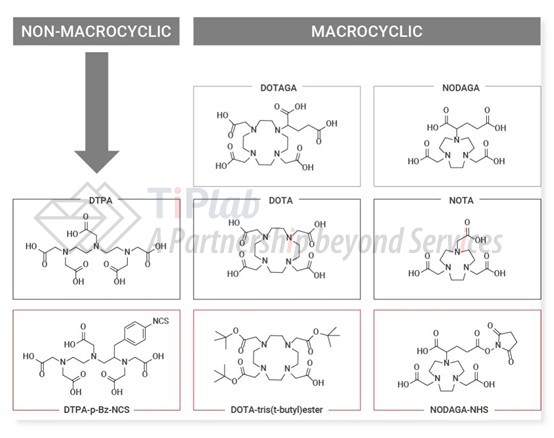
对于连接子和螯合剂,领域内也有了较为成熟的研究。常见的连接子包括可裂解连接子和不可裂解连接子,例如,硫醚键和腙键等。常见的螯合剂包括DOTA(1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸)、NOTA(1,4,7-三氮杂环壬烷-1,4,7-三乙酸)和DTPA(二乙烯三胺五乙酸)及其衍生物等。
目前,放射性核素、连接子和螯合剂的选择多为领域内的常规方案。在这里,我们将不再对于放射性核素、连接子和螯合剂进行探讨,而主要关注以下三个角度的创新:
(1)靶向配体的创新:通过设计新型靶向配体或对现有的配体进行改造,可以提高对肿瘤细胞表面靶点的亲和力,使RDC更多在靶标肿瘤位置富集,最终实现更高的成像质量或更好的治疗效果。
(2)前体组合的创新:通过对前体组合(靶向配体+连接子+螯合剂)的优化,设计合理的RDC整体结构,可以增强药物结构的稳定性,确保放射性核素能够安全、有效地到达肿瘤部位并发挥治疗作用。并且,前体组合的优化还可以调整RDC药物的体内半衰期,改善药物的药代动力学特性。
(3)制剂的创新:由于RDC药物特有的半衰期和放射化学稳定性要求,如何在药物配送和运输过程中保持放射性核素与螯合剂的配位稳定性,是制剂开发中的重要挑战。通过制剂的创新设计,例如开发新型稳定剂或优化药物储存条件,可以显著提升药物的实用性和临床可及性。
靶向配体
靶向配体是RDC药物实现精准定位的关键组成部分,靶向配体与受体的结合能力直接影响RDC的靶向效果和诊断/治疗效果。对于诊断用RDC,亲和力强、特异性高的靶向配体可以使RDC在靶向位置聚集,显影更清晰,可以清楚的观察病灶位置和边界。对于治疗用RDC,亲和力强、特异性高的靶向配体可以更好的将放射性核素带到靶细胞附近,使RDC具有更好的精准识别肿瘤抗原的能力。
对于RDC而言,靶向配体的开发中,还需要全面评估靶向配体在RDC药物中亲和力和特异性。即使在其他靶向治疗领域(例如ADC)中已被验证效果良好的靶向配体,也需要重新评估其在RDC中的适用性。例如,螯合剂的引入可能会影响其与受体的结合能力。
企业在开发RDC过程中,如果在靶向配体的筛选过程中发现了具有好的亲和力和特异性的靶向配体分子,可优先考虑对配体分子本身进行专利保护,而如果验证了已有靶向配体分子在RDC药物中仍能维持好的亲和力和特异性,也可以考虑对靶向配体分子在RDC中的应用进行保护。基于这种专利保护策略,可以确保靶向配体分子的结构及其在RDC中的应用不被竞争对手模仿,并为后续RDC药物开发提供更全面的保障。
前体
前体的制备是RDC产品合成过程中的重要步骤。由于放射性核素在制备出后便自发开始核衰变,RDC药物通常采用分步合成策略:先制备出不包含核素的前体,在需要对患者使用前再合成核素并立刻与前体反应生成RDC药物。前体通常包括靶向配体、连接子和螯合剂三个核心组分。
在前体的开发中,一般会将靶向配体、连接子和螯合剂视为一个整体进行优化。这种优化同样需要满足:
(1)体内稳定性与靶向性:前体需要具有良好的体内稳定性。在复杂的体内环境中,比如在pH、蛋白酶等影响下,放射性核素可能会在体内脱落,增加放射性核素的非特异性分布,导致RDC诊疗效果衰减或产生毒副作用。
(2)药代动力学匹配性:前体的体内药代动力学特性需与所选用放射性核素的半衰期精确匹配。前体的药代动力学受靶向配体、连接子和螯合剂的共同影响。对于短半衰期核素(如68Ga,半衰期约68分钟),其能够用于诊断,适配的前体需具备快速体内清除特性,便于RDC药物在发挥完其诊断功能后能够及时的从体内代谢到体外。对于长半衰期核素(如177Lu,半衰期约6.7天),适配的前体则需具有更持久的体内滞留时间,使得RDC药物能够在病灶处停留足够的时间来杀伤靶细胞。
落脚到专利保护,企业可以从创新前体的角度入手,通过专利构建多维度的保护体系。例如,保护前体的核心结构特征、优化的合成工艺、以及前体在不同疾病治疗中的应用。这种保护策略可有效阻止竞争对手在相似技术路径上的跟进。比如,限制竞争者将通用前体与不同的核素螯合并应用在多种RDC产品中,从而限制其研发与商业化,使企业在RDC市场竞争中占据有利地位。
制剂
在RDC药物的运输、储存和使用过程中,放射性核素的衰变会持续发生,释放的高能辐射会诱导RDC药物的分子化学键断裂,从而使RDC药物诊断或治疗的功效降低。如何在药物配送运输过程中保持放射性核素与螯合剂的配位稳定性,是该领域独有的技术问题。
针对这一问题,人们探索了各种策略,其中一些有效的解决方案是通过稀释RDC药物浓度或添加稳定剂,来减少放射性药物的辐解(放射性药物在辐射作用下发生的化学分解过程),以延长药物的保质期和提高其稳定性。
因此,除了RDC具体结构外,企业还可以通过保护经改进的制剂方案,比如,保护包含特定稳定剂或缓冲剂的制剂,以延长RDC产品的专利保护期,进一步增强市场竞争力。
在明确了可能的创新角度后,我们将在接下来的文章中详细展开RDC领域相应的专利保护实施建议,探讨理想保护范围和可能遇到的专利审查问题。即,如何合理确定发明创造的保护范围,既能全面覆盖发明创造的核心技术,又能有效阻止竞争对手的模仿和绕过行为;以及如何证明发明创造具有创新性或技术优势?
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
