Akari 在与 Peak Bio 合并中获得了新型毒素 PH1、PH5 和 PH6 的专有权,该合并于 2024 年 11 月完成,合并之后重点集中在 ADC 和 ADC 平台的开发上。在合并之前,Akari 专注于自身免疫和炎症疾病领域,合并后其在研药物补体抑制剂 nomacopan 和 PAS-nomacopan 的开发已暂停并计划寻求外部合作用于支持ADC的开发。
新型毒素的作用机理不同于常用的微管抑制剂和 DNA 损伤剂,如拓扑异构酶 I 抑制剂,其中,PH-1 靶向肿瘤细胞中的剪接体(Spliceosome),PH-5 干扰肿瘤细胞的DNA错配修复过程,PH-6 杀伤肿瘤细胞和促肿瘤免疫细胞。
先导分子 PH1(Thailanstatin 类似物)是一种RNA剪接抑制剂,具有双功能作用机制:一方面,PH1通过破坏生成成熟 mRNA 过程中起关键作用的剪接体来杀死癌细胞;另一方面,剪接体功能障碍会导致错误剪接RNA的积累,并产生被称为新表位的非天然蛋白质,从而激活B细胞和T细胞,进一步杀死癌细胞。
主要候选产品 AKTX-101,将 PH1 与 Trop2 抗体相结合,目前处于临床前阶段。AKTX-102 是一种新型双特异性 ADC,利用 PH1 作为有效载荷,靶向多种实体瘤中存在的两种关键抗原。

Peak Bio 的前身是 pH Pharma,其具有涉及毒素分子 Thailanstatin 类似物的专利家族PCT/US2018/051721,中国授权专利CN111788208B保护多个化合物通式结构、具体毒素分子以及基于ADC的通式结构。
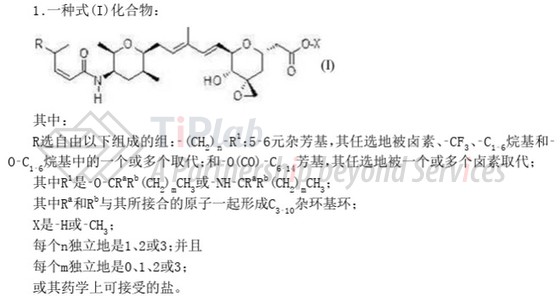
Peak Bio 后续递交了涉及ADC、linker-payload等中间体或其制备方法的专利家族PCT/US2024/024997,权利要求1限定了ADC中毒素分子的具体结构,部分从属权利要求中还限定了linker的具体结构和抗Trop2抗体的序列。实施例中证明了Trop2 PH1 ADC在 KRAS、BRAF 和 FGFR3 等关键致癌驱动因素存在下,仍能够诱导细胞毒性。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
