历经撤市风波的Tysabri
Tysabri® (活性成分:Natalizumab,那他珠单抗)是一款重组人源化IgG4κ单克隆抗体,能够结合除中性粒细胞以外的所有白细胞表面上表达的α4β1和α4β7整联蛋白的α4亚基,白细胞依靠α4-整联蛋白与内皮细胞上的受体粘附从而进入组织,因此natalizumab可以防止白细胞穿过内皮迁移到发炎的组织中,从而用于治疗炎性疾病。
1992年,斯坦福大学和Athena Neuroscience (后来被Elan Pharmaceuticals收购)的研究人员首先发现了α4-整联蛋白在白细胞向大脑中发炎组织的迁移过程起关键作用。动物实验发现靶向α4/β1的抗体可用于治疗中枢神经系统的炎性疾病。1997年,研究人员对natalizumab 的安全性和药代动力学性质进行了研究。2000年,Biogen和Elan达成合作,共同对natalizumab在多发性硬化症和克罗恩氏病的治疗中的应用进行开发。基于两项三期临床试验的积极效果,FDA通过Fast Track加速审批通道于2004年批准natalizumab上市,用于治疗复发性多发性硬化症 (MS)。也就是说,natalizumab从靶点的首次发现至产品获批仅仅用了12年时间,也证实了natalizumab在临床试验中表现出显著的治疗效果并且填补了未满足的医疗需求。
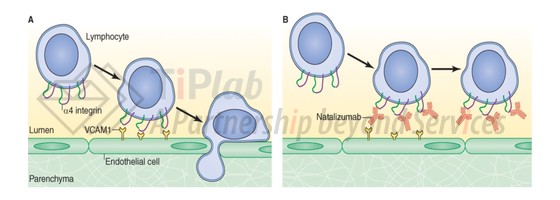
然而在获批后仅四个月,有两例接受过natalizumab和interferon beta-1a联合治疗的患者患上了进行性多灶性白质脑病 (PML)。而后,Biogen主动将natalizumab从市场上撤回。在对临床试验期间的患者重新进行数据收集后证实该副作用尚在可接受的范围内,时隔两年,FDA再次批准natalizumab的上市销售。同年,EMA (欧盟药品管理局)也批准了natalizumab的上市请求。这是美国唯一一款因安全性问题撤市后又获批的药物。此后,临床医生会通过一种生物标志物—抗JC病毒 (John Cunningham virus,会引起PML)的抗体来对患者的用药风险进行判断。2008年,FDA又批准Tysabri®用于治疗克罗恩氏病。剂型都是静脉注射剂型。2013年,Biogen从Elan收购了Tysabri®的所有权利。
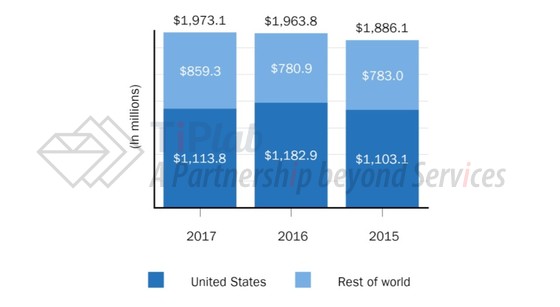
虽然Tysabri®存在潜在的副作用,但好的疗效还是为Biogen带来了不错的收益。2017年,Tysabri® (每月单价大概6000美元)的全球销售额已达到19亿美元。
保护natalizumab的专利
自上世纪90年代起,Biogen和Elan陆续为natalizumab申请了专利保护,其中US5730978A和US5840299A已经到期,分别保护治疗用途和活性成分本身。

US6602503B1同样保护抗体的活性成分,其它的权利要求还涉及编码抗体的核酸、宿主细胞、抗体制备过程、治疗组合物和治疗方法等。US6602503B1将于2020年到期,是继两件已过期的专利之后阻止竞争对手的一大障碍。
US7807167B2是一个治疗方法专利,保护使用natalizumab或抑制α-4整联蛋白的其免疫活性片段治疗MS的方法,将于2023年到期。
Tysabri®撤市后,为了研究natalizumab与PML副作用之间的关系,并提高natalizumab的使用安全性,Biogen建议在使用前对患者体内的抗JC病毒抗体的水平进行检测,并对抗JC病毒抗体呈阴性的患者施用natalizumab,在用药过程中还需监测患者是否具有PML的症状,然后再对患者的治疗方案进行调整。US9493567B2就是保护这一方法,保护期至2027年。
Biogen还拥有一些保护抗体制剂的专利,这些专利遭到了来自印度的制药公司Swiss Pharma的挑战,Swiss Pharma先后向专利审判和上诉委员会 (PTAB)递交了三份IPR请求,声称Biogen的三项美国专利US8815236B2、US8349321B2和US8900577B2是显而易见的。这三项专利的权利要求都与natalizumab稳定的液体制剂相关,例如,US8349321B2的权利要求1保护20 mg/mL的natalizumab液体制剂:

US8815236B2的权利要求1与US8349321B2的权利要求1类似,不过natalizumab的浓度范围更大 (大概20 mg/mL至150 mg/mL)。US8900577B2则保护使用US8815236B2中保护的液体制剂治疗多发性硬化症的方法。
三份IPR引用了相同的现有技术以证明涉案专利中抗体的浓度范围是显而易见的,最终PTAB以证据不足为由拒绝了这三份IPR请求。
Biogen将在MS领域中继续领先
除了Tysabri®之外,Biogen在多发性硬化症治疗领域还有几款明星产品,包括Tecfidera® (活性成分:富马酸二甲酯)和Avonex® (活性成分:Interferon beta-1a)等。之前Biogen和Forward Pharma围绕Tecfidera®发生过几个回合的专利战,最终双方达成了和解。而Tysabri®除了经历了撤市风波,还遭到了IPR挑战,好在Biogen将这些问题一一化解了。
目前,Biogen还在进行Tysabri®治疗急性缺血性脑卒中和癫痫的二期临床试验。2017年,EMA删除了Tysabri®治疗儿科疾病的禁忌,并授予了其6个月的专利补充保护证书 (SPC)。不过,Tysabri®也面临来自强有力的竞争对手的压力,比如Genentech的Ocrevus® (ocrelizumab),一款靶向CD20的抗体,2017获得FDA批准用于治疗多发性硬化症,这可能会对Tysabri®的市场份额造成不利影响。不过,有趣的是,Biogen此前曾与Genentech达成过合作协议,拥有Ocrevus®在美国的销售分成。
此外,Biogen还持续在MS治疗方面进行改进,致力于发展下一代MS的药品以治愈疾病可能带来的损害,以继续巩固其领先地位。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
