上篇文章介绍到,由于蛋白降解双功能分子“事件驱动”的作用机制,可以作用于一些没有活性口袋、传统小分子抑制剂不可成药的目标蛋白,从而扩大药物靶点的选择范围,也有望解决一些传统小分子抑制剂所面临的挑战。
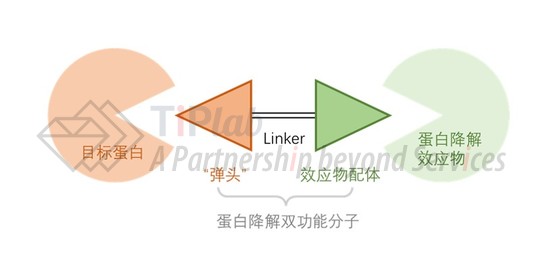
我们回到蛋白降解双功能分子的产品结构本身,其由结合目标蛋白的“弹头”、招募蛋白降解效应物的配体、以及连接这两部分的连接子三个部分组成。虽然连接子及其在两个结合域上结合位点的选择、整体上的分子优化也会影响作用效果,但这些优化依赖于两个结合域的确定,且目前分子优化的一些规律大多依靠经验总结,并不是主要的创新点。
相对而言,“弹头”决定了其降解的目标蛋白,效应物配体决定了目标蛋白将通过何种方式被降解,从目前整个领域的发展情况来看,玩家们主要从这两个部分作为切入点进行创新。接下来我们将围绕这两个部分,展开讨论其中可能的创新方向。
基于结合目标蛋白的“弹头”的创新方向
在设计结合目标蛋白的“弹头”分子时,首先需要考虑蛋白降解双功能分子作用的靶点。理论上来说,其能够作用的目标蛋白及其对应的适应症范围是非常广的,可以涵盖部分已有小分子抑制剂药物上市的靶蛋白以及传统小分子抑制剂不可成药或者难成药靶蛋白。
一方面,基于已有小分子抑制剂药物上市的目标蛋白,蛋白降解双功能分子作为一种新的药物形式,从原理上来说可以克服已上市药物可能存在的问题,例如,高剂量、副作用、耐药性等,仍有实现更好治疗效果的空间。以极易发生突变的药物靶点EGFR为例,目前已有一代、二代、三代小分子EGFR酪氨酸激酶抑制剂(EGFR-TKI)药物被广泛用于临床,每一代的研发都是基于上一代的耐药问题。基于蛋白降解双功能分子在机理上的特点,其有望延缓甚至克服由于长期使用EGFR-TKI导致的EGFR耐药突变问题。目前已有多个靶向EGFR的PROTAC分子被报道,今年7月,FDA已批准C4 Therapeutics针对EGFR L858R突变的降解剂CFT8919的研究性新药(IND)申请。
另一方面,蛋白降解双功能分子可以突破传统小分子抑制剂不可成药或者难成药的靶蛋白,在靶点层面进行创新。目前,仍有大量可通过抑制或降解其功能来实现疾病治疗的靶蛋白尚未开发出对应的治疗产品,尤其是对于没有活性口袋的靶蛋白,例如经典的不可成药靶点KRAS等,传统的小分子抑制剂很难发挥作用。对于这类靶点,蛋白降解双功能分子可以凭借其独特的机理发挥其优势,给疾病治疗带来新的思路。
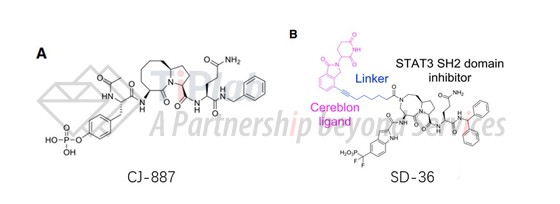
而对于这两类不同的作用靶点,其“弹头”分子均可以直接使用已被报道的小分子,也可以在已知的母核结构上进行优化。例如,靶向EGFR的降解双功能分子,其“弹头”可以基于目前众多的替尼类分子进行设计,相应地解决其耐药性等问题。一些原本只具有结合作用的小分子,也可以作为“弹头”或其改造的基础,在其结合目标蛋白的基础上实现降解。例如,Shaomeng Wang带领的团队开发的首个靶向STAT3的PROTAC SD-36,其“弹头”原本的分子CJ-887具有STAT3亲和活性但缺乏细胞活性,通过分子优化后与来那度胺类似物的组合,得到了强效、选择性和有效的STAT3降解剂,为开发有效的STAT3抑制剂提供了新思路。
基于蛋白降解效应物配体的创新方向
最具代表性的蛋白降解双功能分子PROTAC发展里程碑事件之一,小分子E3连接酶配体的使用,其解决了此前使用的肽类分子细胞渗透性差等问题,将PROTAC的发展推入了新的阶段。由此可见,效应物及其配体的创新对于释放蛋白降解双功能分子的应用潜力十分关键。这部分的创新,并不仅仅局限于开发新的E3连接酶配体分子,还可以挖掘新的E3连接酶以及其他降解系统中的不同组分作为效应物,甚至可以在降解机制的层面也有创新的空间。
目前仅有约10种E3连接酶被用于蛋白降解研究,而人类基因组编码的E3连接酶有600多种,这表明有大量的新的E3连接酶可用于开发目标蛋白降解剂。基于E3连接酶具有组织分布和表达水平的差异,通过不同目标蛋白与不同E3连接酶的适配,可以实现更精准更有效的靶向蛋白降解双功能分子的开发。
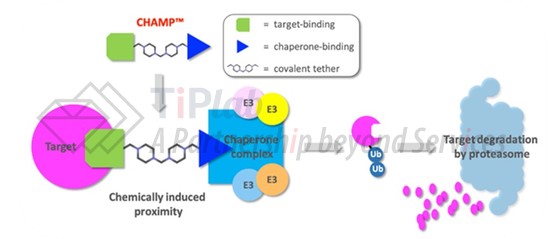
此外,泛素化-蛋白酶体途径中涉及许多参与蛋白降解的组分,E3连接酶也并不是利用泛素化途径实现降解的唯一蛋白降解效应物,针对一些其他可使目标蛋白被泛素化的效应物开发配体分子,也可以形成蛋白降解双功能分子。例如,识别错误折叠蛋白质的分子伴侣,热休克蛋白90(HSP90),可直接与许多不同的E3泛素连接酶相互作用,从而辅助蛋白质降解完成,基于此Ranok Therapeutics开发了分子伴侣介导的蛋白降解剂CHAMP,其中的蛋白降解效应物即为分子伴侣。由于分子伴侣可能在肿瘤细胞中高度激活,这类蛋白降解双功能分子可能具有更好的肿瘤特异性而在效果上具有优势。
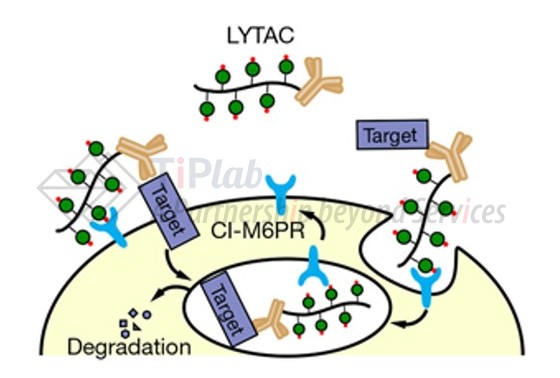
近年来,随着人们对溶酶体途径的研究,其也被应用于蛋白降解双功能分子中,从而扩展蛋白降解双功能分子可作用的靶点范围和应用场景。例如,通过内吞作用将靶点蛋白运送到溶酶体进行降解的LYTAC,是一种利用细胞表面溶酶体靶向受体 (LTRs),如阳离子-非依赖甘露糖-6-磷酸受体CI-M6PR和去唾液酸糖蛋白受体ASGPR,介导蛋白质向溶酶体运输的系统。其效应物配体是能与LTRs结合的长链,可以保证靶点蛋白能够被LTR介导进入溶酶体降解。另外,也有通过自噬体将靶点蛋白运送到溶酶体进行降解的自噬靶向嵌合体AUTAC、自噬连接化合物ATTEC被开发。相对于泛素-蛋白酶体途径更多地是用于降解胞内的蛋白,溶酶体途径中的降解效应物开发,则有望更好地实现膜蛋白、游离蛋白的降解。
基于结合目标蛋白的“弹头”和降解效应物配体的不同创新方向的讨论,我们可以看到目前领域内,侧重在“弹头”进行创新的玩家更多地是基于PROTAC这种已被初步验证的形式,在已知的抑制剂或结合剂分子的基础上获得新的蛋白降解双功能分子。那么对于这类玩家,在考虑专利策略时更需要关注对应的专利带来的风险。而对于主要在降解效应物及其配体上进行创新的玩家而言,其受到现有技术的限制相对较少,所面临专利带来的风险也没有那么复杂,在专利策略上可以更多地关注专利整体的布局策略。那么,对于这两类不同的玩家,在专利风险和布局上又有哪些需要考虑的层次和关键点呢?我们将在接下来的文章中更为具体地探讨。
