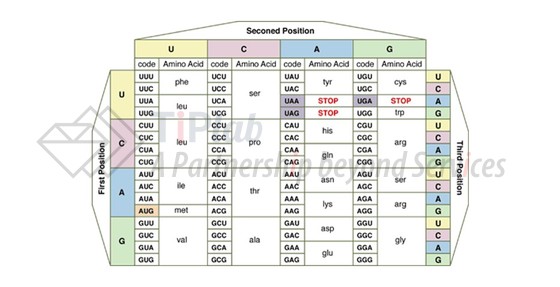
在mRNA中,四种核苷酸每三个一组形成共64种密码子,除终止密码子UGA、UAA和UAG(natural termination codon,NTC)无同源tRNA外,剩余61种密码子能够与同源tRNA中的反密码子互补配对,翻译编码20种氨基酸(图1)
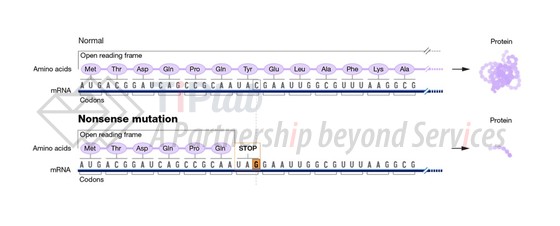
密码正确时,三种NTC一般出现在基因表达框的末端外显子中,而当正确的三联体密码子突变为终止密码子时(也称为“过早终止密码子”,premature termination codon,PTC),由于终止密码子不具有相应的同源tRNA,因此翻译推进到PTC提前停止,产生不完整的肽链从而导致相关疾病。这样的突变被称为无义突变(图2),是tRNA疗法在“密码错误”引发问题的主要应用场景。
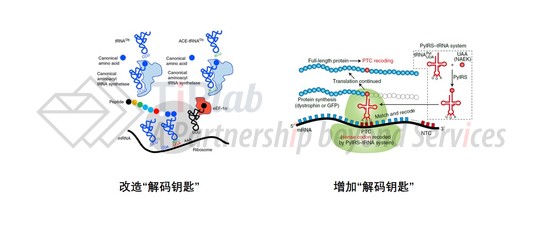
为了解决由无义突变导致的相关疾病,相关疗法均以实现过早终止密码子的通读为研发方向,而tRNA疗法中,主要分为1) 改造“解码钥匙”;和2) 增加“解码钥匙”两种的设计思路(图3)。
我们将分别介绍这两种设计思路,介绍它们各自的发展历程及主要的技术特点,以及对于本领域的玩家来说,在专利方面需要关注的问题。
第一类:针对“错误密码”,改造“解码钥匙”
与核酸药物类似,工程化tRNA疗法涉及的技术特征主要分为三类,工程化tRNA、核酸的修饰以及体内递送,这些特征决定着工程化tRNA能否实现能够纠正密码子错误,稳定的递送到体内发挥治疗效果。
工程化改造的主要思路是改造tRNA的反义密码子区,使其能够结合突变后的过早终止密码子,这样在翻译推进到无义突变的过早终止密码子时,工程化tRNA进行三联密码子的通读,实现全长蛋白的合成(图4)。
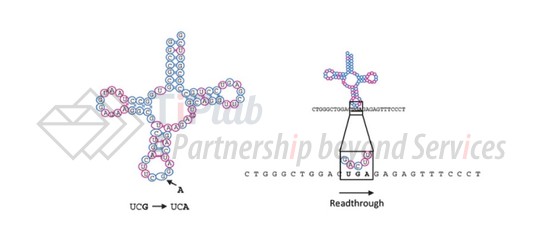
早在1982年,为了识别并通读β-地中海贫血的UAG无义突变,Yuet Wai Kan等人工程化改造人类tRNALys的反义密码子区,将AAA突变为TAG,使其能够与过早终止密码子UAG互补,并在翻译时引入Lys,研究结果也证明了这类tRNA疗法设计策略的有效性。由于Yuet Wai Kan等人设计思路的公开,突变天然tRNA的反义密码子区使其互补结合终止密码子的设计策略,目前已不会有宽泛的难以绕开的基础专利风险,倘若存在大概率也已经届满失效。
随着tRNA疗法的发展,近20年领域内也仍旧存在大量采用这类思路设计tRNA的相关报道。
2014年Carla Oliveira发表的文章介绍了在tRNAArg中突变反义密码子区,开发用于治疗由PTC引起的遗传性弥漫型胃癌综合征(Hereditary diffuse gastric cancer,HDGC)的tRNA疗法。之所以选择Arg的tRNA作为改造基础,是根据密码子突变引起HDGC的相关数据统计中,Arg是受突变影响最多的类型。
针对无义突变疾病中突变频率高的密码子tRNA进行改造,也是早期许多研究者开发时的常见思路。这也同样映射了工程化tRNA疗法的潜在优势,由于许多无义突变导致的疾病由相同的提前终止密码子造成,因此相同的工程化tRNA理论上可以实现多种疾病的PTC通读(图5)。
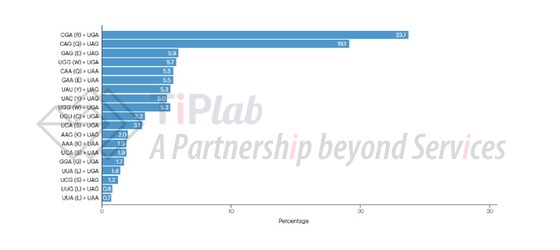
2019年,Christopher A. Ahern等人同样改造了tRNAArg的反义密码子区用于fibrosis transmembrane conductance regulator(CFTR)无义突变造成的相关疾病。
而在专利方面,以Christopher A. Ahern为发明人的US授权专利US11661600B2,授权的保护范围涉及修饰的tRNA,除限定tRNA中的反义密码子是5′-UCA-3′外,权利要求中还限定tRNA中受体臂连接Arg,并进一步限定了tRNA的具体序列。权利要求中并未限定具体的疾病类型,意味着如果工程化tRNA序列与专利保护的序列一致,并且在结构上受体臂连接Arg,无论用于治疗任何无义突变疾病,都可能面临来自这件专利的潜在风险。
这类授权专利的存在也提示进行tRNA反密码子区改造的玩家,由于工程化tRNA的通用性优势(相同无义突变引起的疾病,可能通过同一类氨基酸tRNA进行治疗),因此在考虑潜在侵权风险时,也需警惕在同源氨基酸tRNA基础上进行改造的相关保护(例如不限定具体适应症类型的专利障碍)。
与多数核酸药物类似,工程化tRNA的修饰也是领域内研究的方向之一。在生物体内,tRNA的修饰与其稳定性、与mRNA密码子的解码以及与核糖体的结合等有关系。
早期在2000年,LESLIE A. LEINWAND等人将表达工程化tRNA的质粒注射入小鼠体内开展相关研究时,科学家们认为tRNA中某些重要位点修饰的缺失是造成体内活性效果差的主要限制因素。领域内也存在涉及保护tRNA中核苷酸修饰和位置的相关申请,例如EP4202045A1,因此在进行产品设计以及后续商业化行动中,也需关注涉及tRNA修饰的专利风险。
除此之外,工程化tRNA的体内治疗效率一定程度上也受递送系统的影响。近几年,领域内也尝试了许多已经经过临床验证的递送方式用于tRNA的体内递送(图6)。
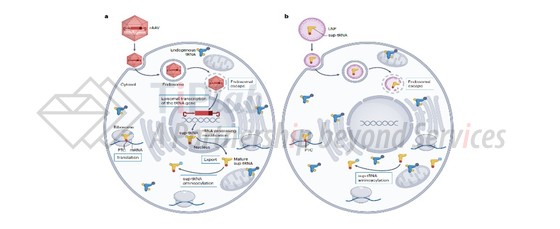
2022年Dan Wang和Guangping Gao等人发表的文章,使用rAAV载体递送工程化tRNA到小鼠体内,在给药6个月后仍旧有良好的安全性和稳定的疗效。2023年,Zoya Ignatova等人则利用肺靶向的LNP包封tRNA实现肺部的精准递送。因此就专利风险而言,未来产品开发选择不同的递送系统面临的潜在风险情况不同,除来自递送系统自身的风险外,也需关注特殊保护工程化tRNA递送组合/方法等类型的潜在专利风险。
2015年以来,ReCode Therapeutics、Tevard Biosciences、Shape Therapeutics等公司纷纷成立,现在希望加入工程化tRNA疗法赛道的玩家,除在产品商业化前需考虑相关风险外,在管线开发前期,构建专利壁垒阻止潜在竞争对手也是需要同步关注的。
由于工程化改造tRNA的反义密码子区早在40年前就已经有相关报道,随后领域内也一直不断探索tRNA疗法在不同基因/不同疾病中的应用,包括近年来在工程化tRNA有效性得到基本验证的基础上,技术优化更侧重于提高体内抑制效率的细节调整。
因此,受现有技术的影响,TiPLab认为工程化tRNA仅从“反义密码子区突变”进行专利布局的难度较大,大概率需要结合具体序列、相关基因突变/适应症或者tRNA修饰开展不同层次的保护更为合理。而tRNA的修饰与tRNA的递送,除与工程化tRNA分子结合进行保护以外,也可以考虑单独进行保护,可布局的空间也不单单取决于修饰或递送系统在tRNA疗法领域应用情况,也很大程度受各自发明本身的效果数据与原理的影响。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
