ALK抑制剂Alectinib
肺癌作为发病率最高的恶性肿瘤之一,已成为我国恶性肿瘤死亡原因的第1位。非小细胞肺癌(NSCLC)约占所有肺癌的80%。随着分子生物学和肿瘤免疫学的发展,NSCLC的治疗朝向更加精准的方向发展。NSCLC驱动基因蛋白抑制剂目前已有EGFR、ALK、ROS1和BRAF等“靶向治疗”型药物上市。
大数据显示,肺癌中ALK融合突变比例为3% - 8%,中国肺癌患者中ALK融合突变比例为5%左右。
Alectinib是一种新型小分子酪氨酸激酶抑制剂(TKI),能选择性靶向ALK和RET(转染重排)。
在美国和欧盟,该药分别于2015年12月和2017年2月获得加速批准和有条件批准,用于既往接受过克唑替尼(Crizotinib, Xalkori®)治疗的ALK阳性晚期NSCLC成人患者的二线治疗。
2018年8月,alectinib获得国家药品监督管理局(NMPA)批准,正式在中国上市。
今年,Chugai向日本卫生劳动福利部(MHLW)提交alectinib的新适应症申请,用于治疗复发性或难治性ALK融合基因阳性间变性大细胞淋巴瘤。
Alectinib通吃ALK一线二线
对于ALK阳性的NSCLC患者,NP28673、NP28761两项临床试验确定了alectinib在二线治疗中的地位。使用克唑替尼一线治疗的患者多数会在服药1~2年后出现耐药,alectinib被推荐用于克唑替尼治疗产生耐药后的ALK阳性肺癌二线用药。
Alectinib不甘于二线用药,ALEX、J-ALEX、AF001JP三项临床研究确立了alectinib用于一线治疗的地位。ALEX是首个alectinib与克唑替尼进行头对头比较设计的III期研究,并获得了令人振奋的结果。主要疗效终点无进展生存期(PFS)达到空前的34.8个月,而且显著降低疾病进展和死亡风险达63%。肿瘤缓解率(ORR)达82.9%,患者的肿瘤缓解深度明显优于克唑替尼。Alectinib能透过血脑屏障,在中枢神经系统(CNS)中保持活性,故该药针对脑转移瘤也具有疗效。
基于III期临床研究ALEX的数据,FDA于2017年11月批准alectinib用于ALK阳性NSCLC的一线疗法。2019年,美国国立综合癌症网络(NCCN)指南推荐alectinib作为接受一线治疗期间发现ALK重排患者的首选药物。
2018年罗氏财报显示,尽管alectinib上市晚于辉瑞和诺华的同类产品,但是凭借出色的疗效,2018年收入达到6.37亿瑞士法郎。
Alectinib的精准设计
Chugui公司通过高通量筛选技术对激酶化合物库进行筛选发现具有较好开发前景的四环母核结构的衍生物。接着对该类衍生物依次进行活性筛选、结构优化最终得到代谢稳定的alectinib。
Alectinib含有一种独特的苯并[b]咔唑衍生物支架结构,该结构能与ALK激酶高效结合,从而表现出对ALK的高选择性及抑制效果。
Alecensa®活性成分
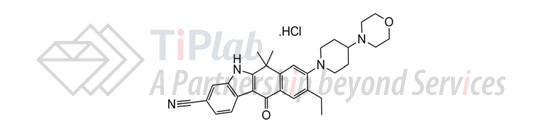
Alecensa®硬胶囊为阿莱替尼盐酸盐配制而成。阿莱替尼盐酸盐的分子式为C30H35ClN4O2,分子量为519.08。阿莱替尼盐酸盐具有以下化学结构:
Alecensa®制剂
FDA批准的Alecensa®制剂为硬胶囊。
每粒硬胶囊包含150 mg的阿莱替尼(相当于161.33 mg 阿莱替尼盐酸盐)。辅料包含乳糖一水合物、羟丙基纤维素、十二烷基硫酸钠、硬脂酸镁和羧甲基纤维素钙几种无活性的成分。
围绕alectinib的专利申请
活性成分及医药用途专利家族
2010年,Chugai递交了涉及alectinib活性成分的PCT专利申请 (PCT/JP2010/059785)。
PCT/JP2010/059785进入美国国家阶段的授权专利为US9126931B2,其权利要求1保护一种四环结构的通式化合物,限定了多个取代基,其范围涵盖alectinib活性成分。US9126931B2的专利期调整时间为354天,预计将于2031年5月到期。
US9126931B2的分案US9440922B2涉及alectinib的治疗用途,权利要求1保护一种通式化合物,用于治疗癌症、癌症转移或抑郁症,限定了化合物的结构通式。US9440922B2的化合物范围与母案US9126931B2有所区别,预计将于2030年6月到期。
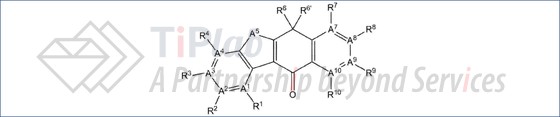
PCT/JP2010/059785进入中国国家阶段授权专利CN102459172B涉及一种通式如下的化合物或该化合物的盐:
Chugai于2013年递交的PCT/JP2013/075621专利家族涉及alectinib用于治疗RET突变的肿瘤。
制剂专利家族
Chugai首先于2011年递交了涉及药物组合物的PCT国际申请 (PCT/JP2011/068735)。
PCT/JP2011/068735进入美国国家阶段已经获得了授权 (授权公告号: US9365514B2),权利要求1保护一种组合物,该组合物包含alectinib活性成分或其盐、药学上可接受的载体及溶出助剂(十二烷基硫酸钠),其保护范围涵盖FDA批准的说明书中的alectinib制剂。
PCT/JP2011/068735进入中国国家阶段的授权专利ZL201180040147.8的权利要求1为:

权利要求1中保护一种组合物,限定了组合物包含的组分以及alectinib与表面活性剂的重量比。
为了解决水难溶性或不溶性化合物溶出性低的问题,Chugai优化了alectinib的辅料组成并于2015年递交了PCT国际申请PCT/JP2015/062520,在日本的授权专利JP5859712B1的权利要求1中限定化合物的含量为140 mg-190 mg,涵盖FDA批准的说明书中的alectinib制剂。
晶型专利家族
晶型专利在小分子专利保护中的作用不容小觑。涉及alectinib晶型的PCT/JP2015/062516专利家族已经进入了CN/US/JP等国家阶段,其中在日本已经获得授权,在中国仍处于审查阶段,公开号为CN106458967A,在审的权利要求1限定了粉末X射线衍射图的峰位置:

“靶向治疗”型药物使肺癌成为慢性病
“靶向治疗” 型药物的效果一般显著优于化疗。近几年,该类药物的研究获得各制药公司的青睐。
Alectinib一线用于ALK阳性NSCLC的PFS高达34.8个月,这不仅意味着晚期ALK阳性肺癌患者使用alectinib可以实现近3年的疾病无进展生存,就如正常人一样生活;也意味着“把晚期肺癌变成慢性病”,已经由梦想变成了现实。
“靶向治疗”型药物的发展也预示着将会有更多晚期癌症患者有了长期生存的可能,当然该类药物的研究也远比人们想象的复杂,如今已上市的一些“靶向治疗”型药物,已经发现对机体免疫功能有抑制作用。
目前,可靠的“靶向治疗”型药物需要具备几个特点:靶点在肿瘤中具有特异性的表达或相对正常组织的更高表达、靶点具有强的肿瘤驱动性或抑制性、药物能到达肿瘤组织并能选择性的抑制或激活靶点。
未来的挑战则在于开发更为可靠的“靶向治疗”型药物以实现更有针对性和更有效的疾病治疗。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
