ADC therapeutics
ADC Therapeutics成立于2011年,总部在瑞士洛桑,致力于开发用于治疗血液癌症和实体瘤的新型ADC药物,其ADC产品由靶向特定抗原的单克隆抗体和PBD二聚体通过Spirogen Limited的PBD技术偶联而成。

Spirogen Limited是AstraZeneca生物制剂研发部门MedImmune的全资子公司。ADC药物研究领域公认的领导者Dr. Martin是SpirogenLimited的联合创始人及CEO,其在ADC Therapeutics的组建中也发挥着重要的作用,自ADC Therapeutics成立以后一直在董事会任职。2015年,Dr. Martin被任命为ADC Therapeutics公司的CEO。
PBD二聚体技术
2012年,ADC Therapeutics与Spirogen达成共同开发ADC药物的合作协议,获得使用Spirogen的PBD二聚体技术的权利。
PBD(Pyrrolobenzodiazepine)
PBD是一类早在20世纪60年代就发现的抗肿瘤抗生素,PBD二聚体由两个PBD单体形成,是有效的DNA小沟(minor groove)结合剂。
当PBD二聚体与DNA的小沟结合后,可以与DNA的N2位置的鸟嘌呤之间形成氨基交联,阻止DNA与转录因子的结合,引起细胞复制停滞,最终导致细胞死亡。其发挥作用不依赖细胞的复制周期,引起的DNA损伤较难修复,表现出更好的细胞毒性。
涉及PBD的专利保护
早期很多PBD二聚体是由Spirogen合成,1999年,Spirogen递交了国际申请PCT/GB1999/002838,其对应的美国授权专利US7049311B1涉及一种pyrrolobenzodiazepine,其权利要求1限定了pyrrolobenzodiazepine单体的结构通式。
US7049311B1的延续案US7067511B2和US7265105B2,涉及一种pyrrolobenzodiazepine二聚体,US7067511B2获得了504天的PTA,预计2021年1月到期。
涉及PBD二聚体技术的专利保护
因PBD二聚体良好的细胞杀伤作用,其已演变成ADC研究领域一类重要的细胞毒素。Spirogen 专有的PBD二聚体技术中PBD通过其N10或C2共轭位点与linker偶联形成PBD二聚体-linker-抗体ADC。
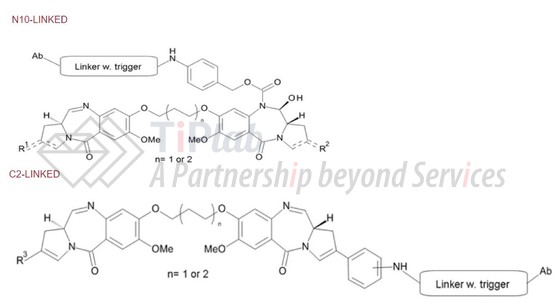
当基于PBD的ADC进入体内后,linker被切割断裂释放出PBD和抗体,发挥抗肿瘤活性。
针对N10/C2-Linked的偶联方式,2013年MedImmune(2013年,Spirogen被MedImmune收购)递交了国际申请PCT/EP2013/071236。
PCT/EP2013/071236进入中国国家阶段的专利申请CN109134599A的权利要求2为:
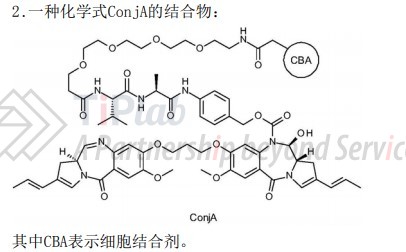
请求保护一种N10-linked PBD二聚体-细胞结合剂的结合物ConjA。CN109134599A目前处于审查阶段,尚未获得授权。
CN109134599A的美国同族专利US9889207B2已经获得专利权。US9889207B2的权利要求2保护一种PBD二聚体-CBA偶联物,选自N10-linked的ConjA和ConjB。
ADC Therapeutics的研发管线
借助于PBD二聚体技术,ADC Therapeutics开发了丰富的产品,针对的癌症主要包括乳腺癌、前列腺癌、肾癌和血液癌等。这些ADC产品中进展较快的有ADCT-402和ADCT-301。

靶向CD19的ADCT-402
ADCT-402(loncastuximab tesirine)
ADCT-402由RB4v1.2和SG3249组成,RB4v1.2是靶向CD19 的人源化IgG1抗体。CD19是Ⅰ型膜糖蛋白,局限地表达于B细胞发育和分化的阶段,但持续地表达于B细胞恶性肿瘤如B细胞来源的白血病和非霍奇金淋巴瘤细胞上。
SG3249(又称tesirine)由PBD二聚体SG3199和组织蛋白酶B可裂解的二肽(Val-Ala)接头组成,并包含能够增加其溶解度的PEG8 spacer。
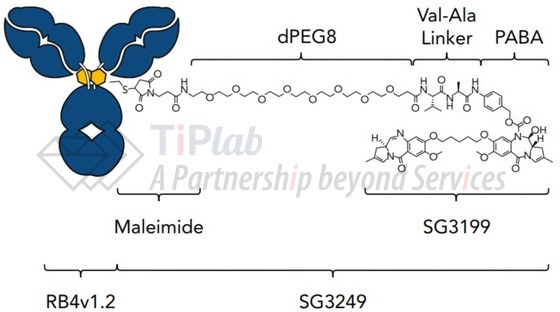
目前,ADCT-402正在进行治疗复发或难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)的Ⅱ期临床试验(NCT03589469)、与ibrutinib联用治疗R/R DLBCL或套细胞淋巴瘤(MCL)的Ⅰb期临床试验及与durvalumab联用治疗R/R DLBCL、MCL及滤泡性淋巴瘤(follicular lymphoma)的Ⅰb期临床试验(NCT03685344),并获得了FDA授予的用于治疗R/R DLBCL和MCL的孤儿药指定。
涉及ADCT-402的专利保护
针对ADCT-402,2013年10月11日,ADC Therapeutics递交了涉及PBD-抗体结合物的国际申请PCT/EP2013/071346。
PCT/EP2013/071346进入了CN、US和EP等国家和地区,其中进入中国国家阶段的申请已经获得专利权,授权公告号为CN105050661B,保护一种靶向CD19的抗体-PBDs二聚体偶联物,限定了抗体重链和轻链可变区氨基酸的序列。
PCT/EP2013/071346对应的美国专利US9931414B2保护一种靶向CD19的抗体-PBD二聚体的偶联物,限定了重链或轻链可变区的氨基酸序列,并限定了药物的载药量(drug loading)是1至8。
靶向CD25的ADCT-301
ADCT-301(camidanlumab tesirine)
ADCT-301由HuMax®-TAC和SG3249组成,HuMax®-TAC是对CD25(又称IL2R-α)具有高度亲和力的全人抗体,许可自Genmab。
CD25是一个经过充分临床验证的治疗靶点,其在多种血液肿瘤细胞上均有表达,且在正常组织细胞上的表达有限。
2013年,Genmab与ADC Therapeutics达成合作协议,共同开发包含HuMax®-TAC和PBD的新型ADC,用于治疗表达CD25的淋巴瘤和白血病。
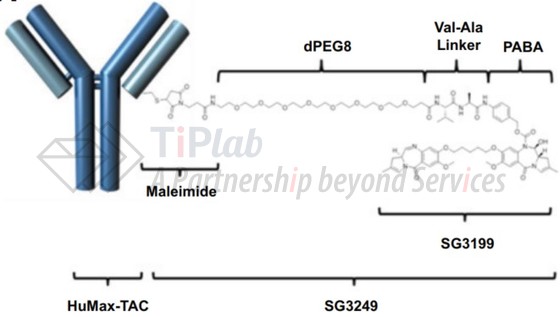
目前,ADCT-301正在进行治疗复发性或难治性霍奇金淋巴瘤和非霍奇金淋巴瘤的Ⅰa/Ⅰb期临床试验(NCT02432235),及治疗实体瘤的Ⅰb期临床试验(NCT03621982)。
涉及ADCT-301的专利保护
在2013年10月11日同一天,ADC Therapeutics递交了涉及靶向CD25的抗体-PBD二聚体偶联物的国际申请PCT/EP2013/071349,并进入了CN、US和EP等国家地区。
PCT/EP2013/071349进入中国国家阶段的CN105102068B的权利要求1保护一种抗CD25-PBD抗体偶联物,限定了抗体重链和轻链可变区的氨基酸序列。
CN105102068B的美国同族专利US9931415B2的权利要求1保护一种抗CD25-PBD抗体偶联物,限定了抗体重链CDR的氨基酸序列,并限定了药物的载药量(drug loading)是1至8。
结语
基于PBD二聚体技术,ADC Therapeutics开发了丰富的研发管线,并针对具体的产品管线进行了专利布局积累专利资产,这些为其吸引了众多的合作与投资。
今年4月份,ADC Therapeutics与天演药业(Adagene)达成合作许可协议,ADC Therapeutics将使用天演药业自主研发的精准掩蔽技术SAFEbody开发针对实体瘤的新一代ADC药物。
目前,ADC Therapeutics正在进行多项ADC产品的临床试验,并计划于2020年下半年提交ADCT-402用于治疗R/R DLBCL的生物制剂许可申请(BLA)及启动ADCT-301治疗霍奇金淋巴瘤的关键性Ⅱ期临床试验。
2019年7月,ADC Therapeutics宣布完成了总额高达3.03亿美元的E轮融资,这笔资金为其临床规划提供了强有力的支持,有助于早日将其ADC产品推向市场。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
