随着CRISPR系统在体内编辑的广泛验证,如何有效递送使体内编辑类药物更好的发挥药物活性成为了领域内关注的热点。以CRISPR/Cas系统为例,目前相对成熟的递送方式主要以病毒递送载体AAV和非病毒递送载体LNP为主,但由于各自固有的局限性,也驱动着领域内玩家持续探索新型递送方式。
这其中,围绕VLP(Virus-like Particle,病毒样颗粒)的研究进展,显示了其在体内编辑药物递送方面的潜力。以张锋和David Liu等为代表的基因编辑领先研究团队相继报道,VLP能够通过mRNA或RNP(ribonucleoprotein,核糖核蛋白)的形式,有效递送CRISPR/Cas、碱基编辑器BE和先导编辑器PE;国内本导基因基于自研的VLP-mRNA平台,开发了CRISPR抗病毒基因编辑药物BD111,目前已推进到临床I期。
这些研究结果表明VLP兼具病毒载体和非病毒载体的优势,既能有广泛的靶向性,同时又能在体内瞬时递送mRNA、蛋白质或RNP。
VLP是由病毒结构蛋白组装形成的颗粒结构,只保留了病毒的骨架,不包含基因组核酸,目前研究比较多的VLP是基于逆转录病毒载体和慢病毒载体衍生而来的。
以逆转录病毒为例,病毒颗粒内部包裹两端存在LTR序列的RNA,这些RNA编码各种结构形成病毒骨架的结构蛋白Gag(包含MA、CA、和NC蛋白)、Pol(包含IN、RT和PR蛋白)、Env和其他调节蛋白,5’-LTR序列具有调控gag/pol/env的表达、启动逆转录和整合基因组的功能,并且其下游存在病毒包装基因组RNA所必须的ψ信号。
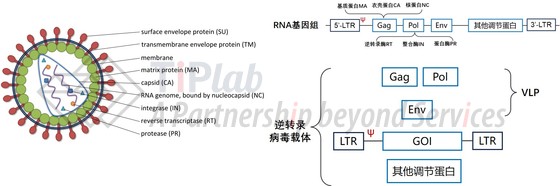
传统的逆转录病毒载体,将LTR中间的片段替换为目标基因,利用结构蛋白Gag和Pol形成的衣壳将目标基因包装到病毒颗粒内、随后通过包膜Env介导的受体结合、内吞作用将目标基因递送到细胞内;并且能够在5’-LTR的辅助下利用结构蛋白Pol编码的整合酶将目标基因整合进入靶细胞的基因组中。
VLP则是在此基础上进行删减,只保留负责组装成病毒包膜和衣壳的Gag-Pol蛋白,去除LTR和其他调控蛋白。因此VLP既有成熟的慢病毒载体和逆转录病毒载体的包装和靶向特性、瞬时表达编辑酶的能力,同时也避免了外源基因整合靶细胞基因组的可能性。
由于没有5’-LTR下游片段的包装信号ψ,VLP如何能够在衣壳组装过程中将mRNA、蛋白或RNP包装到壳内,是实现VLP高效递送的关键问题之一。
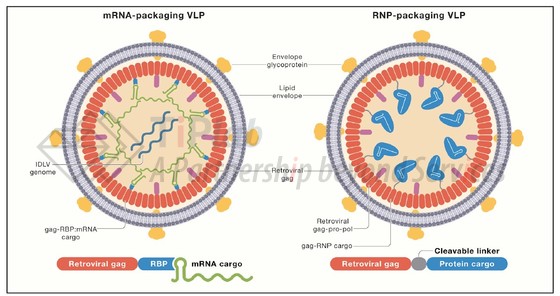
通过对该领域的研究与调查,我们发现,针对这一技术问题领域内在持续不断地产生新的解决方案。对于后续想要进入该赛道的玩家,围绕VLP的包装问题,伴随技术发明所产生的专利策略,对后续技术的专利布局有什么借鉴的地方吗?对于想要在现有基础上进行改进的玩家,有哪些潜在的专利风险需要注意?在本系列的文章中,我们将围绕VLP递送mRNA和RNP 2种体系的包装问题,与大家分享我们在技术发展和专利策略中的相关研究。
