不含Fc区的双特异性抗体技术
不含Fc区的双特异性抗体因比较小,更易穿过组织及肿瘤细胞到达目标位置。由于不含Fc区,这类双特异性抗体不能介导效应子功能,如:ADCC和CDC效应,且半衰期较短。
下面,我们对不含Fc区的代表性双特异性抗体的平台技术进行概述。
DART
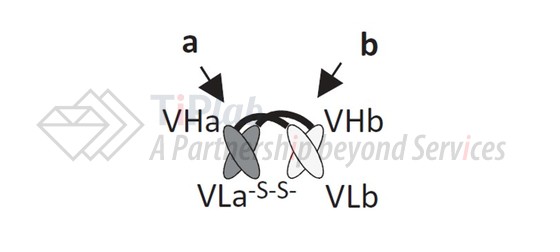
DART( Dual affinity re-targeting)是一种由两条多肽链结合形成的异源二聚体抗体,首先使用接头连接VH和VL形成scFv,之后共表达两个scFv片段使得VL和VH结构域通过链间相互作用形成双特异性片段,DART由MacroGenics开发而成。
此外,在两条多肽链的C末端引入了半胱氨酸形成链间二硫键,可以提高产品的稳定性。
MacroGenics已经与强生、施维雅和辉瑞等制药巨头达成了合作。
MacroGenics用于保护其平台技术的代表性专利申请包括PCT/US2008/066957,已经进入了EP和CN等国家阶段。
MacroGenics与施维雅合作开发的flotetuzumab (CD3 × CD123,MGD006)正在进行治疗急性髓性白血病和骨髓增生异常的1期临床试验。保护该产品的代表性专利家族包括,例如PCT/US2014/051790,其也已经进入了US、EP、CN等国家阶段。
DNL
Immunomedics与IBC Pharmaceuticals合作开发了Dock-and-Lock (DNL)平台技术,DNL技术利用了环AMP依赖性蛋白激酶A (PKA)的二聚化结构域和A-激酶锚定蛋白 (AKAP)的锚定结构域之间的相互作用形成一种稳定的拴系结构,从而可以开发多价、单特异性或多特异性抗体等。
IBC递交了一系列保护DNL平台技术的专利申请,其中包括PCT/US2006/012084。
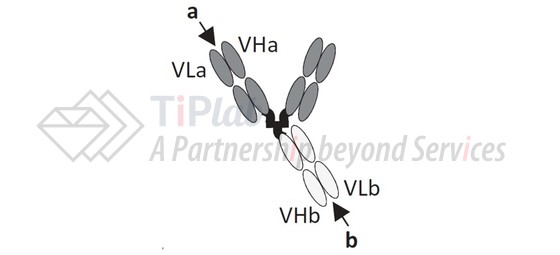
与血液肿瘤相比,免疫疗法在实体瘤的治疗方面面临更大的挑战,Immunomedics利用DNL技术开发了T细胞重定向的双特异性抗体用于治疗实体瘤:
其中,(E1)-3s是一种靶向Trop-2/CD3的双特异性抗体,Trop-2在一些实体瘤中 (比如,胰腺癌和胃癌)高表达,CD3是T细胞表面的抗原。通过同时结合Trop-2和CD3,(E1)-3s可以诱导T细胞介导的杀伤作用,在人胰腺癌和胃癌的动物模型中,(E1)-3s显著抑制了其肿瘤生长,加入IFNα可以进一步增强肿瘤抑制活性。
涉及(E1)-3s的代表性专利申请包括,例如:PCT专利申请 (PCT/US2013/054842)和US专利申请 (授权公告号:US9315567B2),其中,US9315567B2的权利要求1保护使用包含Trop-2和CD3结合位点的T细胞重定向复合物诱导对Trop-2阳性癌细胞的T细胞介导的细胞毒性免疫应答。
TandAb
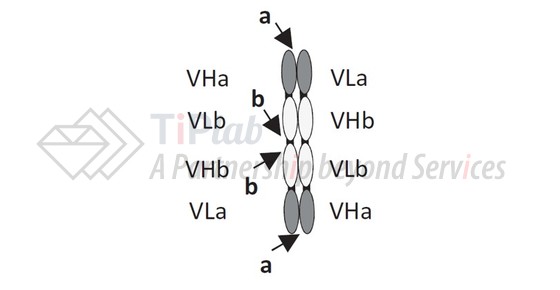
TandAb是利用ROCK (Redirected Optimized Cell Killing,重定向优化细胞杀伤)平台开发的一类四价双特异性抗体,包含四个scFv结构域,由Affimed开发而成。
Affimed与Genentech达成了高达50亿美元的合作,共同开发新型肿瘤免疫疗法。
保护TandAb的代表性专利申请包括:PCT/EP2002/010307和PCT/EP2011/062673,其中:PCT/EP2011/062673在中国的授权专利 (CN103687879B)保护一种二聚抗原结合分子,由第一多肽链和第二多肽链构成,其中每条多肽链的N-末端到C-末端按VLA-VHB-VLB-VHA的顺序排列,并限定了抗原结合分子的连接方式,是保护TandAb平台技术的重要专利。
AFM13 (CD30 × CD16A),可以诱导NK细胞对肿瘤细胞周围发动攻击,引发ADCC效应。AFM13与Merck的Keytruda联用治疗霍奇金淋巴瘤正处于临床1期阶段。
AFM11 (CD19 × CD3)诱导T细胞结合肿瘤细胞,并使其发挥细胞杀伤作用,正处于治疗急性淋巴细胞白血病和非霍奇金淋巴瘤的临床1期阶段。
BiTe
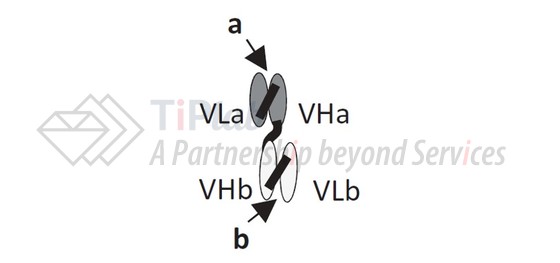
BiTe由Micromet (2012年被Amgen收购)开发而成,是一种串联型的scFv,具有一个结合T细胞抗原 (通常是CD3)的scFv和结合肿瘤相关抗原的scFv串联而成。BiTe可同时结合T细胞和肿瘤细胞并诱导T细胞对肿瘤的杀伤作用。
Micromet利用BiTe平台开发的blinatumomab (CD19 × CD3)于2014年获得了FDA的批准 (商品名:Blincyto®),用于治疗费城染色体阴性前体B细胞急性淋巴细胞白血病。2018年,FDA又批准Blincyto®用于微小残留病阳性前体B细胞急性淋巴细胞白血病成人及儿童患者的治疗。Micromet递交的代表性专利家族—PCT/EP1999/002693家族涉及对blinatumomab进行保护。
Amgen目前仍有多款BiTe在研药物,比如AMG 330 (CD33 × CD3)正处于治疗急性髓性白血病的1期临床试验阶段;AMG 420 (BCMA × CD3)正在进行治疗多发性骨髓瘤的1期临床研究阶段。
Nanobody
Nanobody首先由Ablynx (2018年被Sanofi收购)开发而成,是一种单域抗体 (Single domain antibody),来自于骆驼及羊驼体内的一种缺失轻链的重链抗体的可变区片段。Nanobody可以通过接头连接从而实现多特异性结合。
Ablynx拥有约100个专利家族涵盖纳米抗体相关平台技术和候选产品。
Nanobody的主要优点是分子小、稳定性高、易于连接,小尺寸使其易于穿过较深的组织并靶向一些正常IgG抗体难以靶向的表位。不过,缺乏Fc区的纳米抗体在体内的循环半衰期较短,可以通过融合人血清白蛋白或白蛋白结合蛋白以延长半衰期。
Ablynx已经与诺华、诺和诺德、默克、艾伯维、勃林格殷格翰等多家药企达成了合作。
Vobarilizumab (ALX-0061,靶向白蛋白和IL-6R),正处于治疗类风湿性关节炎 (NCT02518620)和系统性红斑狼疮 (NCT02437890)的2期临床研究阶段。PCT/EP2007/058587家族是保护vobarilizumab的代表性专利家族之一。
BsAbs产品开发过程中的专利风险
不难发现:
早期进入该领域的玩家们的模式基本是首先发展其平台技术,并进行专利保护,这些专利将具有巨大的商业价值;然后开发特定的候选产品再进行针对性的专利保护,而有了平台技术作支撑就可以不断与制药公司达成合作或被其收购。
随着双特异性抗体制备技术的不断发展,已涌现出多个新的或改进型的专利技术,比如:
Zymeworks和Xencor基于算法设计在CH3结构域引入一组突变以获得异源二聚体,并分别开发了Azymetric平台技术和XmAb平台技术;
中国的企业,例如康宁杰瑞自主研发的CRIB (Charge repulsion improved bispecific)双特异性抗体平台技术通过调整不同Fc链之间的电荷分布以构建异源二聚体,基于CRIB平台构建的双特异性抗体分子保持了完整的抗体分子框架结构,在热稳定性以及Fc生物学活性方面与野生型抗体无显著差异。
双特异性抗体的一大特点是结构多样化,各有其优势,不同技术的专利保护情况也比较复杂。因此,相关企业在进行产品开发的过程中除了针对自主开发的产品构筑高质量专利壁垒外,还需要密切关注潜在的专利风险,结合其商业策略尽早进行专利风险排查,对于一些难以绕过的平台技术可以考虑通过外部许可或合作的方式来降低潜在的侵权风险。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
