Nilotinib经分子设计解决伊马替尼耐药性
Nilotinib是一种BCR-ABL激酶抑制剂,来自对伊马替尼(imatinib,格列卫®)的分子改造,能够与突变的ABL蛋白激酶结构域的失活构象结合,并使其稳定,因此可抑制对imatinib耐药的BCR-ABL突变型的激酶活性。
诺华对imatinib分子进行改进时,保持原结构式的2-胺苯基-4-(3-吡啶基)嘧啶的骨架固定不变,变换连接基-CO-NH-,将N-甲基哌嗪替换为甲基咪唑,并在苯环上引入三氟甲基。 两者分子式如下:
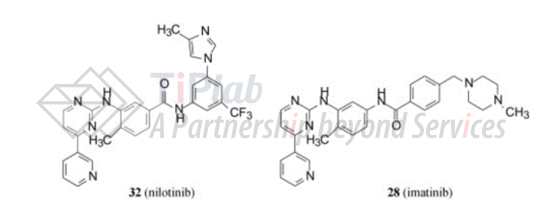
2018年3月22日,美国FDA批准诺华研发的nilotinib(商品名为Tasigna®)用于年龄一岁或以上慢性期费城染色体阳性的慢性髓性白血病(Ph+ CML-CP)患者的一线及二线治疗。
这是继2007年10月nilotinib首次获批用于治疗对包括imatinib在内的既往治疗耐药或不耐受的慢性期或加速期的费城染色体阳性的慢性髓性白血病(CML)成年患者,和2010年获批用于治疗新诊断Ph+ CML的慢性期成人患者后的又一适应症扩大。
在中国,nilotinib于2009年获批上市,随后在2016年和2019年分别获得适应症扩大,用于治疗包括imatinib在内的既往治疗耐药或不耐受的慢性期或加速期的费城染色体阳性的CML成人患者、新诊断的费城染色体阳性的CML成人患者和两岁以上的CML儿童患者。
Nilotinib活性成分
药用的nilotinib是其盐酸盐一水合物,化学式为C28H22F3N7O•HCl•H2O,分子量为584。用于口服的nilotinib是一种胶囊剂,包括50 mg、150 mg或200 mg无水nilotinib碱三种规格,含有胶体二氧化硅、交聚维酮、乳糖一水合物、硬脂酸镁和泊洛沙姆188这些无活性成分。
围绕nilotinib的专利申请
诺华为了克服imatinib用药过程中出现的BCR-ABL蛋白的抗药性,基于imatinib与BCR-ABL复合物晶体结构和结合特征,针对BCR-ABL耐药突变,进行分子设计得到二代激酶抑制剂nilotinib。
通式化合物专利建立牢固保护
2003年7月4日,诺华递交了nilotinib活性成分的PCT专利申请PCT/EP2003/007198。
PCT/EP2003/007198进入美国国家阶段的授权专利为US7169791B2,独立权利要求1涉及式I的通式化合物,和该化合物的N-氧化物或可药用盐:
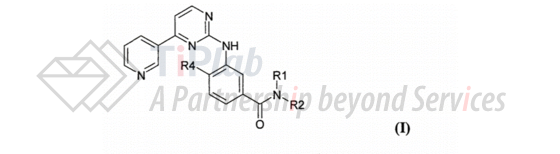
从属权利要求2-7则围绕目标化合物设置了不同范围的保护层次。这里,独权尽可能大的涵盖了nilotinib和结构相似的分子,有效阻止竞争对手绕开该范围。从权则层层递进,逐渐收拢,涵盖了实施例中效果较好的衍生物。独立权利要求8则单独保护了nilotinib化合物本身。
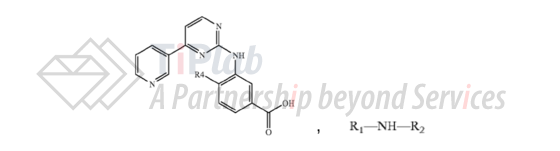
此外,US7169791B2的独立权利要求9保护了式I化合物或者其N-氧化物或可药用盐的合成方法,即,使用以下两种化合物反应得到式I化合物的方法都会落入该保护范围。
独立权利要求10和11则分别涉及包含式I化合物或者其N-氧化物或可药用盐的药物组合物,和使用式I化合物或者其N-氧化物或可药用盐治疗白血病的方法。
PCT/EP2003/007198进入中国国家阶段的专利授权公告号为CN1324022C,权利要求保护范围与同族的美国专利稍有不同。
虽然nilotinib活性成分专利数量不多,但是已经涵盖了通式化合物、具体化合物、化合物的合成方法等,每一项权利要求都以nilotinib为中心,建立了层次化的稳定的保护。
之后,在nilotinib上市前夕或之后,诺华陆续递交了关于nilotinib的外围专利申请,包括晶型、制备方法及制剂等。
盐类化合物和晶型专利为对手设置障碍
Nilotinib获批产品为盐酸盐一水合物,因此,2006年7月18日,诺华递交了国际申请PCT/US2006/027875和PCT/US2006/027878,对nilotinib的盐和晶型设计了严密的专利保护。
PCT/US2006/027878
PCT/US2006/027878进入美国国家阶段的授权专利为US8163904B2,独立权利要求1和4分别涉及nilotinib的单盐酸盐和单盐酸盐一水合物,权利要求2则涉及nilotinib单盐酸盐一水合物的制备方法。
PCT/US2006/027878进入中国国家阶段的授权专利为CN101228151B,权利要求1涉及nilotinib的单盐酸盐一水合物。
PCT/US2006/027878的授权分案US8389537B2则保护了使用nilotinib盐酸盐一水合物治疗CML的方法。
PCT/US2006/027875
PCT/US2006/027875进入美国国家阶段的授权专利US8343984B2的权利要求涉及nilotinib盐酸盐的晶型A,获批上市产品为nilotinib盐酸盐一水合物,因此不是上市产品中的晶型。
2012年8月3日,在PCT/US2006/027875的基础上,诺华又递交了涉及nilotinib盐酸盐一水合物晶型的分案申请,授权专利号为US8415363B2,根据橙皮书的披露,该晶型可能为上市产品的晶型。权利要求1使用X射线粉末衍射图谱对晶型B进行了限定,如下:

可以看到,诺华在研发过程中针对不同的盐类化合物的晶型进行了尝试并递交了专利保护,不管这些晶型是否为最终拟上市产品的晶型,都对潜在侵权者进行了有效打击,也为仿制药厂设置了更多的障碍,从而延迟甚至阻止仿制药的出现。
制剂专利解决成药难题
比较nilotinib和imatinib的分子式,前者咪唑环的碱性显著低于后者的哌嗪环,实验也证明nilotinib的溶解度显著降低,很难配制和递送,对成药应用有很大限制。那么诺华又是如何解决这个难题的呢?
2007年9月25日,诺华递交了制备方法专利申请PCT/EP2007/060165,进入美国国家阶段的授权专利为US8293756B2,其权利要求涉及一种药物组合物的制备方法,包括通过湿法制粒方法制备包含nilotinib盐酸盐一水合物的颗粒,还进一步包括将颗粒填入胶囊。权利要求1如下:

2012年9月21日,诺华递交了US8293756B2的分案申请,也获得了授权,授权专利为US8501760B2,涉及一种胶囊剂形式的药物组合物,包含nilotinib单盐酸盐、0-1%(w/w)的表面活性剂和不超过1%(w/w)的润滑剂,从属权利要求2和3进一步限定所述润滑剂和表面活性剂分别为硬脂酸镁和泊洛沙姆。此外,该药物组合物还进一步包含乳糖一水合物。这些物质均出现在获批上市的nilotinib产品成分中。
PCT/EP2007/060165进入中国国家阶段的专利申请并未获得授权,以此为母案提出的分案申请CN201410535689.8目前仍在审查中。
2010年11月17日,诺华递交了PCT/US2010/056926,其进入美国国家阶段的授权专利US9061029B2,涉及nilotinib或其可药用盐治疗细胞增殖性疾病的方法,包括将nilotinib或其可药用盐分散在水果制品中,以向患者施用。该方法不影响nilotinib的生物效用,解决了某些患者,如老人或儿童,吞服胶囊剂较困难的问题。
US9061029B2的同族中国专利授权公告号为CN102612368B,权利要求1仅涉及将nilotinib盐酸盐的一水合物分散在苹果酱中用于治疗CML。
“精心设计”的药物结构与专利保护
诺华首先在通式化合物专利中设置了层级保护,随后的盐类化合物专利和保护不同晶型的晶型专利对竞争对手的跟踪研究可能造成了障碍,而制剂专利中解决了nilotinib的成药难题,在一定程度上也延长了产品的专利保护期。可以看出,诺华不仅针对性地设计出了nilotinib的分子结构,围绕nilotinib的专利布局也是精心设计的产物。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
