阳离子脂质概述
阳离子脂质(cationic lipid)是LNP递送系统中最关键的组分,具有与带负电荷的核酸结合、有助于内涵体逃逸、核酸药物体内转染、pH敏感性等多个特点。
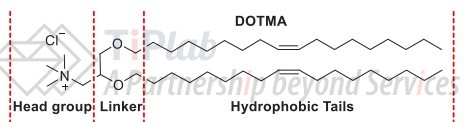
阳离子脂质决定了LNP递送系统的递送效率和转染效率,它有三个重要的结构区域:极性头部(head group)、疏水尾部(hydrophobic tail)以及连接链(linker)。其中:
极性头部可以是伯胺、仲胺和叔胺,或季铵盐以及磷、胍基、砷、咪唑和吡啶鎓基团,影响脂质带电情况,在溶酶体逃逸过程也起主要作用;
连接链由酯、醚、氨基甲酸酯或酰胺组成,决定了阳离子脂质体的化学稳定性和生物可降解性;
疏水尾部可以由不饱和的或饱和的脂肪链组成,其中,碳链的长度、是否饱和、具体类型都将影响脂质行为,其既为脂双层提供足够的流动性,又能促使阳离子脂质体在体内的脂质融合。
基于LNP递送技术,目前已有4款(包含紧急使用授权)产品进入市场,递送的核酸药物涉及siRNA和mRNA。该技术成功应用于疫苗领域,强有力的抑制了新冠疫情在全球范围内的蔓延。
阳离子脂质发展
当下,多款阳离子脂质已经过临床验证,他们具备哪些结构特征,研究人员是如何一步步确定该结构的构效关系的呢?下面,我们梳理一下阳离子脂质结构的优化历程及代表性的专利保护情况。
第一代阳离子脂质——季铵盐脂质/永久带电的脂质
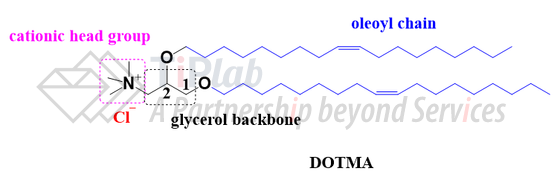
早在1987年,Felgner等人合成了首款阳离子脂质DOTMA,并将DOTMA作为载体用于基因传递。DOTMA是永久带电的脂质,也是第一代阳离子脂质的代表。
1989年,Felgner等人又成功实现利用阳离子脂质DOTMA将mRNA输送到培养细胞中。随后,为了确定DOTMA引起高转染效率的结构特征,1999年,Ren等人合成了一系列DOTMA类似物进行验证,最终发现,成对的油酰基链(oleoyl chain)通过醚键连接到甘油主链的1,2位是该结构具备高转染效率的主要原因。
20世纪末期,人们对上述季铵盐类脂质的构效关系、体外疗效等进行了广泛的研究,但这类永久带电的阳离子脂质和相关的脂质体制剂,截至目前并未成功进入临床,主要原因在于这类脂质具有不可接受的毒性、较短的循环半衰期以及与带负电的细胞和细胞外成分的非特异性关联。
第二代阳离子脂质——可电离脂质
为降低第一代阳离子脂质的毒性、增加转染效率,Pieter Cullis、MacLachlan等科学家开发了第二代阳离子脂质,即可电离脂质。
可电离脂质的特殊之处在于,正常生理pH值条件下它们呈现电中性,并且,由可电离脂质组成的LNP会具有较小的毒性和较长的体内循环周期。此外,在内涵体等细胞器的酸性环境中,可电离脂质会被质子化,转变为带有正电荷的状态,从而更易与内涵体膜发生融合,促使被递送的核酸药物得以从内涵体中逃脱,快速进入到细胞质中发挥疗效。
1994年,Cullis及其团队披露了第一个可电离脂质DODAP(1,2-dioleoyl-3-dimethylammonium propane),并证明可通过pH梯度诱导合成氨基脂质的不对称分布来调节膜融合(DOI:org/10.1021/bi00208a007,1994)。
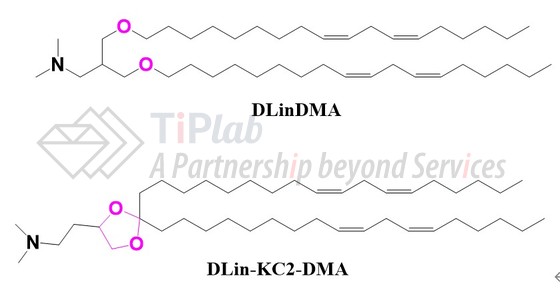
2005年,MacLachlan团队提出阳离子脂质饱和度或影响包封核酸的细胞内递送,证明了烷基侧链含多个不饱和位点的阳离子脂质可以引起更有效的转染。基于此,设计合成了含DLinDMA(1,2-dilinoleyloxy-N,N-dimethyl-3-aminopropane)或DLenDMA的稳定的核酸-脂质颗粒(SNALP),并递交了涉及结构通式的PCT申请(PCT/CA2005/000885,Protiva)。
随后,为了增加递送效率,Arbutus和UBC合作将DLinDMA连接子中的醚替换为缩酮,从而获得了DLin-KC2-DMA。此种化学变化降低了DLin-KC2-DMA的转变温度,当它与内体膜中天然存在的阴离子磷脂相互作用时,可促进其形成六边形结构的能力,该过程被认为可促进内体释放。
彼时,LNP领域存在一个亟待解决的问题——治疗窗口太窄,随着剂量提升毒性出现非常陡峭的急剧增加,为了找到能提高LNP安全和活性的新型可电离脂质,Alnylam与Pieter Cullis以及两名前Inex员工Thomas Madden和Michael Hope建立了合作关系,成立了一家名为AlCana的公司,开始了对新型可电离脂类的探索,最终发现了MC3脂类(包含DLin-MC3-DMA)。
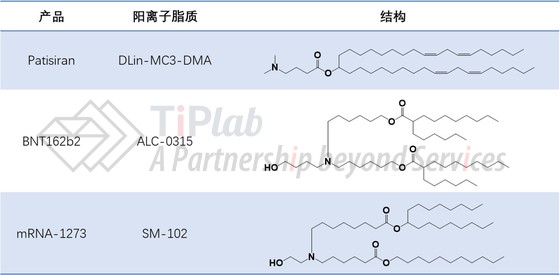
Alnylam针对MC3脂类和特定的DLin-MC3-DMA均递交了专利申请进行保护,相应专利预计2030年到期。一系列实验证明DLin-MC3-DMA构建的LNP可有效沉默TTR基因且耐受性良好,这些发现促进了首个RNAi治疗药物Onpattro®(Patisiran)上市。
第三代阳离子脂质——可生物降解脂质
为了进一步推进LNP递送平台,Alnylam结合了药物载体的重要特征——生物降解性,期望将可生物降解特征引入阳离子脂质以提高它们的生物相容性和/或促进消除。
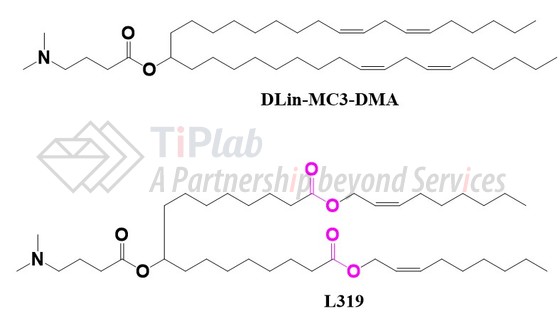
Alnylam在DLin-MC3-DMA的脂质尾部引入酯键得到了可生物降解脂质L319,与DLin-MC3-DMA相比,该脂质在体内表现出更好的递送效率和更快地从肝脏和血浆中清除。随后,Alnylam递交了多个专利家族,保护L319的化合物和可生物降解脂质平台。
PCT/US2012/068491家族(‘491家族)涉及结构通式的可生物降解脂质平台,目前已进入包括美国、欧洲在内的多个国家和地域,并获得多项授权。
同样,Acuitas和Moderna借鉴了Alnylam的可生物降解构思,设计的SM-102和ALC-0315具有比DLin-MC3-DMA更好的体内递送功效和药代动力学。其中,SM-102和ALC-0315分别是mRNA-1273和BNT162b COVID-19疫苗中的阳离子脂质组分。SM-102和ALC-0315的头部基团含有一个末端羟基,有文献认为,该末端羟基可有效减少头部基团的水化作用,提高与核酸的氢键相互作用,从而可能提高转染能力。
2022年3月,基于该可生物降解脂质平台‘491家族的代表性专利US11246933B1(‘933专利),Alnylam向辉瑞和Moderna提起诉讼,指控辉瑞和Moderna各自的COVID-19疫苗,侵犯了‘933专利权利要求18、19、21、22和24-27,要求辉瑞和Moderna给予合适的专利使用费。目前,该案子正处于诉讼阶段。
‘933专利权利要求18,保护了一类生物可降解的阳离子脂质结构通式,范围较宽,权利要求具体如下:

生物降解基团还可同时包含酯键和二硫键,此类可生物降解脂质体中,二硫键断裂产生的浓缩疏水硫醇(concentrated hydrophobic thiols)可驱动对酯连接链的亲核攻击,最终加速该脂质的降解。
早在2014年,中科院化学所汪铭团队和美国塔夫茨大学许巧兵团队便设计合成了同时包含酯键和二硫键的可生物降解脂质用于递送siRNA,证明此种结构比非二硫键的脂质体具有更好的递送效率,同时,递交了PCT申请保护该结构通式的平台。
除上述可生物降解脂质外,阳离子脂质疏水尾部还可插入其他类型的生物降解基团,如酰胺等,此处我们并未穷尽。
阳离子脂质的专利保护特点
每代阳离子脂质结构的优化,都伴随着大量的专利布局,涉及技术平台、特定结构以及结构的衍生应用等。近十年,LNP递送技术的发展十分迅速,越来越多的企业进入这个领域,这也预示着这个领域的专利数量将越来越多。
结合当下的研发实践,大多数致力于构建自主研发LNP递送平台的企业,通常会沿用已验证阳离子脂质的结构特征,通过调整部分功能基团,来获得效果相当或更好的特定平台。针对此种情形,我们需要十分注意已验证阳离子脂质的相应技术平台以及结构通式相关专利的潜在风险。
LNP递送技术的成功,除了阳离子脂质外,LNP组合物的组分及其配比也有着不可忽视的贡献,下篇我们继续分享LNP组合物各组分或配比的发现以及相应基础专利的情况。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
