“专利独占权”vs.“市场独占权”
不同于普通商品,药品关系着国计民生,所以制药行业的发展也常常与国家政策、行政监管密切相关。一方面,新药研发伴随着巨大的投入和“九死一生”的风险,如果成功后的收益没有任何保证,势必会大大打击药物研发方的积极性。另一方面,药品是用来治病救人的,而社会有大量得不到满足的医疗需求,所以从某种意义上来讲,全世界的人们都需要用得起的好药。行政监管部门要平衡这两方面的利益,就要控制“原研药”和“仿制药”各自的市场地位,而这主要倚仗的就是两套限时的“独占权”体系:左手是知识产权局授予的限时“专利独占权”,右手则是食药监局授予的限时“市场独占权”。
“专利独占权”是第一道关卡。上一篇文章中讲到,专利权是一种“排他性”的权利,也就是说,获得了专利权,不代表权利人就能够进行药品的合法销售了。专利权只能使权利人阻止其他人制造、使用、销售或者进口相关药品,也就是通过专利权阻止竞争对手的药品合法地进入市场。为了自己能合法地销售药品,药品制造商至少还要跨过第二道关卡,即通过向监管部门证明药品的安全性和有效性等而获得市场准入许可。虽然这两道“关卡”之间存在一定的关联,二者在保护对象、作用和权利行使方式等方面还是有显著区别的。
首先,专利权需要权利人主动“行使权利”才能发挥作用,换言之,如果专利权人不针对侵权行为主动出击,请法院主持公道,“专利证书”就只不过是被雪藏的武器。相反,“市场独占权”是由相关监管部门负责执行的,不需要权利人费心指认或举证。其次,专利权本质上保护的是“新的、有创造性的、能在工业上应用的”技术方案,与药品或产品没有必然的对应关系。事实上,因为专利申请的时间通常较早,很多授权专利的权利要求并不一定能够覆盖或保护最终上市销售的产品。相反,“市场独占权”是与“产品”而非“技术方案”相对应的,其既不必然要求产品有专利保护,也不要求产品涉及的技术是未被公开过的“新”技术,其只关心所涉及的药品是市场上已有的药品还是市场上没有的“新药”。随着名目繁多的“额外”市场保护期(例如,孤儿药、传染病相关药物等)的出现,“市场独占权”正在药品市场竞争格局中发挥着越来越重要的作用。
可见,仿制药若希望合法地上市销售,要么就需要等到原研厂家的“专利独占权”和“市场独占权”都到期,要么就要选择规避相关权利或挑战相关独占权的有效性。对于化学仿制药来说,因为存在例如“橙皮书”这类公开可靠的信息源,围绕专利权的争议相对透明,但是对于生物仿制药来说,事情就扑朔迷离得多。
接下来,以美国为例,我们尝试分别就“市场独占权”和“专利独占权”中的问题进行一些讨论。
市场独占权
市场独占权的设立是为了鼓励企业投入资源开发新药,这也是1984年通过的Hatch-Waxman法案关注的问题之一。一方面,原研药企业认为只有在“市场独占权”的保护下,药品上市后的经济收益才有基本保障,相应地,早期投入的巨额研发费用和所承受的巨大风险才可能是值得的。另一方面,为原研药企业提供“市场独占权”从某种意义上也被看作是允许仿制药企业提交简略新药申请(Abbreviated New Drug Application,ANDA)的“补偿”。在ANDA申请中,仿制药企业只要提供证据表明仿制药产品与原研药具有“生物等效性”即可,在这个过程中,仿制药企业可以参考和依赖原研药厂家的临床试验数据来证明药品的安全性和有效性,而不必自己再重新提交新的证明安全性及有效性的临床数据。
在美国,监管层面的独占期有很多不同的类型。例如,如果原研药厂家开发的是新的化学实体(new chemical entities,NCE),那么可以获得5年的市场独占权,在这5年中,FDA不能接受基于同样活性成分的、来自其它企业的ANDA申请。由于ANDA的审批过程平均为2年左右,再加上5年的市场独占权,那么在将近7年的时间里,NCE的原研药厂家基本上是市场上唯一的卖家。
生物制品的“市场独占权”受《生物品价格竞争和创新法案》(Biologics Price Competition and Innovation Act,即BPCIA)的管控。根据BPCIA,提交完整的生物制品许可申请(Biologic License Application,BLA)并获批的创新型生物制品可获得12年的市场独占权。对提交了儿科用药相关数据的生物制品,还有额外6个月的独占期。这12年的市场独占权从FDA首次批准该品种之日起算,并且它实际上是4+8的结构:前4年时间是数据独占期,在此期间,生物类似药申请者不能依赖原研厂家的临床数据来证明自己的生物类似药的安全性或有效性,而且FDA也根本不会接受生物类似药的上市许可申请;后面8年中,FDA可以接受并且审理生物类似药的申请,但是不能批准任何生物类似药的生产销售。对于递交补充BLA申请(supplemental BLA application)的原研药厂家(例如,用于拓展到新的适应症领域),不再给予任何额外的市场独占权。此外,BPCIA(42 USC §262(k)(7)(C))还明令禁止原研药厂家通过改变适应症、施用途径、剂量、剂型、递送方式等递交新的BLA申请,从而达到延长市场独占权的目的。
需要注意的是,上文讨论的市场独占权只能用来防止竞争对手通过351(k)途径(即作为生物类似药或可互换的(interchangeable)生物制品)来获得产品批件,而无法阻止他人通过351(a)途径(即通过重新递交完整的BLA申请来生产和销售包含同样活性成分的新药)获得产品上市许可。因此,原研药厂家往往需要综合利用监管机构授予的”市场独占权“、专利权和技术秘密来全面地构筑竞争壁垒,只依靠其中的一种手段是不够的。
例如,2013年8月,FDA批准了Teva的tbo-filgrastim,这是一种重组短效G-CSF。Teva这个产品的活性成分跟Amgen的Neupogen一样,在美国以商品名Granix出售,并且Granix被批准用于缩短严重的中性粒细胞减少症的持续时间。虽然Granix的活性成分与Amgen的Neupogen一样,但是在美国市场,它并不是Neupogen的“生物类似药”。Teva是通过351(a)途径向FDA递交的申请,并且没有依赖Amgen的相关临床试验数据。相反,Teva完全独立地提供了自己的试验数据,来证明tbo-filgrastim的安全性和有效性。值得注意的是,Teva的tbo-filgrastim获批的适应症少于Amgen的filgrastim获批的适应症,例如,其中不包括严重的慢性中性粒细胞减少症,干细胞调动,急性髄性白血病和骨髓移植等。在这方面,通过351(k)途径递交的申请与通过351(a)途径递交的申请也显著不同。通过351(k)途径递交申请的企业能够依赖原研厂家的安全性和有效性数据,而将其生物类似药的适应症外推到所有原研药被批准的适应症,只要能证明其生物类似药与原研药在各种分析实验中性质“充分相似”即可。相反,通过351(a)途径递交申请的企业只能依赖自己实际得到的临床试验数据。
化学仿制药的首仿厂家能够获得180天的市场独占权,而对于生物仿制药来说,只有被认为可与原研药“互换”(interchangeable)的首个生物仿制药厂家能够获得“生物仿制药市场独占权”。该“生物仿制药市场独占权”的具体时间长度取决于相关专利诉讼的情况。需要注意的是,所谓的“生物仿制药市场独占权”并不妨碍FDA随后批准另外一家企业针对同一原研药产品生产销售其它“生物仿制药”,它只能阻止FDA在该独占期内批准另一厂家的“生物仿制药”也以“可互换”的身份出现在市场上。因此,这种所谓的“生物仿制药市场独占权”价值有限。
还值得注意的是,生物仿制药也可以获得“儿科独占期”, 这为提供儿科用药数据的生物仿制药提供了额外6个月的市场独占权。
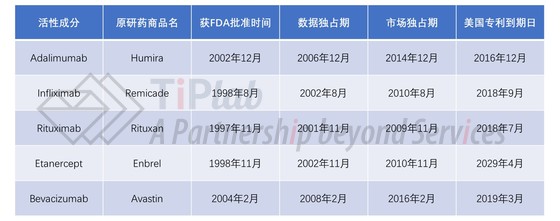
下表中总结了美国市场销量前5名的生物药的独占期情况。
专利独占权
上文中我们主要讨论了与药物产品能否获得批件从而上市销售密切相关的市场独占权的问题。如果原研药不受专利保护,那么市场独占权一过期,仿制药就可以立即上市销售了。因此,对于生物制药企业来说,构建强有力的专利组合就是战略层面上至关重要的一个部分。
在本系列之前的文章中,我们讨论过“专利权”的“排他性”问题(即不是允许专利权人自己实施发明,而是使专利权人能够阻止其他人实施发明)以及获得专利权的基本要求(例如,必须是能够申请专利保护的发明主题,发明必须是新的、非显而易见的且具备工业实用性等)。在这里,我们来尝试着重从商业策略方面探讨一下专利权与产品、以及专利权与市场独占权的关系。
在药品生命周期的任何一个阶段,开发者都可能就某些技术方案递交专利申请和/或获得专利保护。例如,某些保护药品活性成分结构的专利可能在递交NDA或BLA之前或者在NDA/BLA申请的审批过程中被授权,另一些涉及制剂、用途、工艺等的专利可能在之后的一段之间内陆续获得授权。药物开发是持续若干年的过程,而相应地,专利保护也是伴随整个药物开发过程的一系列决策过程,后续递交的一系列申请可以保护第二代、第三代产品,改进的制剂,优化的生产工艺,针对其它适应症的新用途等,这些后续专利的到期日会延后,从而客观上强化药物产品的竞争壁垒。因此,使药品在市场独占权过期之后还能够受到专利保护(即拥有专利独占期),是所谓“专利策略”或“专利布局”的重要目的之一。
从竞争格局的角度看,专利策略也应该是生物医药企业商业策略的重要组成部分。一方面,专利被用来确保企业在自己希望拓展的市场中拥有压倒性的竞争优势;另一方面,专利也被用来阻止竞争对手的产品进入某些市场(即使企业自己并不在该市场开展商业活动)。通常,企业会通过构建专利组合来达到这些目的。
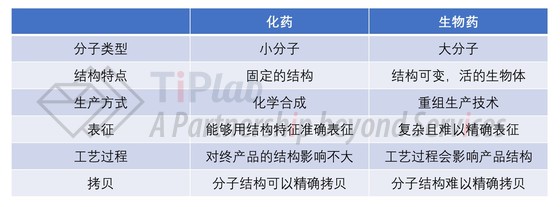
例如,典型的专利组合中有保护药物活性成分结构的专利、有保护使用该活性成分治疗某种疾病的专利、也有保护包含该活性成分的某种施用剂型的专利等。与小分子药物相比,涵盖生物药的专利组合可能涉及到的保护主题更加多样化。这是由多种因素造成的。
例如,生物药品本身的结构就比小分子药物复杂得多,其生产过程常常涉及到利用活的生物体(例如,微生物、细胞、动植物体等),而最终得到的产品与该产品的生产方法之间也常常有错综复杂的关联。
另外,小分子药物的仿制药厂家若想绕开原研厂家保护化合物活性成分的专利是非常困难的,因为化学仿制药的活性成分结构需要跟原研药一致。然而,对于通过351(k)途径报批的生物类似药来说,需要证明的是其与参比药物足够“相似”,所以在某些情况下,生物类似药可能与参比药物的结构并不完全相同,从而成功绕过原研药厂家保护活性成分结构(例如,抗体分子结构)的专利(特别是相关专利授权范围比较窄的时候)。正因为这样,生物创新药企业(比如Amgen)往往特别重视专利布局,保护同一个药品活性成分结构的专利也常常不止一件,而是由保护范围宽窄不一的数件专利组成。
因此,对于生物仿制药企业来说,用于了解产品可能侵犯哪些专利权的自由实施(FTO)分析就成了一项非常有挑战性的工作。任何一个生物药产品都可能受到数十件、甚至数百件专利的保护,这些专利的保护主题可能涵盖核酸序列、氨基酸序列、表达载体、宿主细胞、生产及纯化产品的方法、经优化的稳定制剂、用于产品施用的耗材、针对特定适应症的产品用途等。某一个技术主题(例如,抗体分子结构)也有可能在若干件保护范围有一定差别的专利的范围内。在下表中,我们尝试比较一下小分子药物与生物药的主要区别,以便于我们理解二者在专利布局中面临的不同挑战。
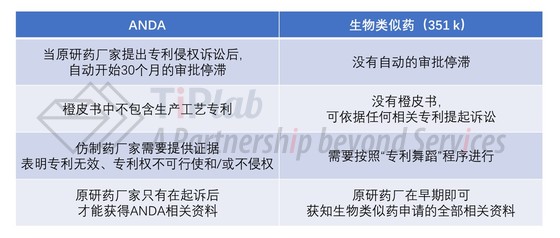
此外,在仿制药报批的过程中,按照ANDA程序递交的申请(例如小分子化合物仿制药)与根据351(k)途径递交的申请(例如生物类似药)在涉及专利挑战和专利诉讼的方面也有很多不同之处。我们尝试在下表中对这些不同之处进行了一些总结。
最后,当我们了解到哪些美国专利可能涵盖相关产品时,如何计算这些专利的确切到期日呢?简单地说,1995年6月8日之后申请的美国专利,其有效期都是至申请日起20年止。然而,具体到每一个美国专利,它的期限计算又可以非常复杂,主要是有各种花式期限延长。主要的期限延长方式有三种,可以概括为两真一假,“两真”是指PTA和PTE,“一假”指的是儿科用药延长。具体来说,PTA(专利期调整,patent term adjustment)是用于弥补USPTO的专利审查过程太长给专利权人造成的损失,而PTE(专利期延长,patent term extension)是为了弥补FDA审批的流程过长给专利权人造成的损失。这两种期限延长的具体时间都可以通过多种方式查到,例如,都可以在USPTO的PAIR系统里查到。6个月的“儿科用药独占期”实际上不会使专利本身的到期日延后6个月,它只是使相关产品的独占期延后了6个月,其实质上是监管部门为鼓励企业开展儿科临床试验而授予的一种特殊形式的“市场独占权”。
总之,生物仿制药企业在制定“出海”策略时,需要综合考虑由市场独占权、专利独占期以及技术秘密共同筑造的竞争壁垒,从而在决策过程中避免顾此失彼,留下隐患。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
