CAR-T
CAR-T(Chimeric Antigen Receptor T-Cell),即嵌合抗原受体T细胞,是近年来发展非常迅速的一种细胞免疫疗法。目前,CAR-T已经在多种实体瘤和血液肿瘤的临床治疗中取得较好的效果。
CAR-T的核心是嵌合抗原受体(CAR),其包括三个部分:抗原结合域(一般可以为单链抗体scFv)、跨膜区和信号转导区。获得编码CAR的重组质粒,在体外通过转染技术将该重组质粒转染到患者的T细胞,转染后经纯化和大规模扩增后产生的T细胞,可称为CAR-T。CAR-T可以在体内和/或体外发挥对表达肿瘤抗原的细胞的高效杀伤能力(参见下图)。
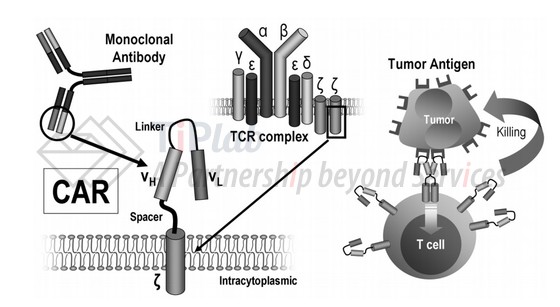
在某种程度上,CAR可以被认为是一种包含抗原结合片段的融合蛋白。CAR-T相关的专利申请的主要争议的法律问题也在于是否具备创造性,并且其创造性也和其中抗原结合片段存在着千丝万缕的关系。
我们将通过CAR-T相关专利申请的一系列复审请求审查决定,初步探讨CAR-T相关专利申请的创造性问题。
首先看一个关于scFv的典型创造性案例:
第一个故事 抗原结合片段的“负面”影响
案件概况
涉案专利申请为CN201280051365.6,申请日2012年10月19日,发明名称为“抗CD22嵌合抗原受体”,申请人为美国卫生和人力服务部。
2017年5月31日,该专利申请被驳回。其中驳回决定所针对的权利要求1为:
1.嵌合抗原受体(CAR),其包含: HA22的抗原结合结构域,跨膜结构域,和细胞内T细胞信号传导结构域。
在驳回决定中,审查员指出,对比文件1(James Scott T et al., Antigen sensitivity of CD22-specific chimeric TCR is modulated by target epitope distance from the cell membrane)公开了一种抗CD22嵌合抗原受体,包括抗CD22 ScFv RFB4、IgG1 Fc、CD4跨膜结构域和CD3ζ的细胞内T细胞信号传导结构域,其可以用于促进表达CD22的B淋巴细胞瘤溶解。可见该专利申请权利要求1的区别技术特征为包含HA22的抗原结合结构域的CAR。
而对比文件4(US2007/0189962A1)记载BL22、HA22是靶向抗原CD22的免疫毒素,其中HA22的细胞毒性相比BL22提高了5-10倍。因此本领域技术人员有动机将对比文件1和对比文件4结合,即选择对比文件4记载的HA22制备CD22嵌合抗原受体。因此审查员认为该专利申请的权利要求1-22不具备创造性。
案件进展
申请人对该驳回决定并不服气,提出了复审请求,并且没有对权利要求进行修改。
在复审请求中,申请人重申,一方面,对比文件1和对比文件4的组合没有任何启示引导得到权利要求1所述的CAR;另一方面,权利要求1所述的CAR获得了预料不到的技术效果(例如权利要求1选择性裂解肿瘤细胞)。
可见案件的争议点在于对比文件1和对比文件4的结合是否是显而易见的。
在前置审查和合议组发出的复审通知书中,审查员和合议组坚持认为,对比文件1已经教导和提示了带有RFB4的结合结构域的CAR在裂解表达CD22的肿瘤细胞方面的作用,因此本领域技术人员有动机选择针对同一抗原表位的抗原结合结构域。也就是说有动机去选择对比文件4中公开的HA22的抗原结合结构域来开发一种新的CAR,从而得到权利要求1请求保护的技术方案。
对此,申请人在答复复审通知书时对权利要求进行了修改:
1.嵌合抗原受体(CAR),其包含: (a) HA22的抗原结合结构域;(b)CD8跨膜结构域或CD28跨膜结构域,和(c)CD28细胞内T细胞信号传导结构域,CD137细胞内T细胞信号传导结构域,和CD3ζ细胞内T细胞信号传导结构域中的一个或多个。
换句话说,申请人通过限定CAR的跨膜结构域与和胞内信号传导结构域对权利要求1进行了进一步限定。
与对比文件1相比,修改后的权利要求1的区别技术特征包括:
(1)HA22的抗原结合结构域;
(2)CD8跨膜结构域或CD28跨膜结构域;
案件结局
合议组对修改后的权利要求1进行审查,其认为修改后的权利要求1所解决的技术问题仅仅是:提供了另一种结合CD22的CAR。这是因为:
对于区别技术特征(1),由于对比文件1教导了带有RFB4的结合结构域的CAR在裂解表达CD22的肿瘤细胞方面的作用(“靶向CD22上RFB4的表位的CAR可以选择性地裂解CD22Hi肿瘤细胞而不显著地裂解正常B细胞”,参见对比文件1摘要);而对比文件4记载HA22中RFB4的结合区被突变,并且HA22对CD22具备更好的结合能力(参见对比文件4的实施例1),因此本领域技术人员有动机选择针对同一靶点表位(CD22上RFB4表位)的抗原结合域HA22来构建CAR。
对于区别技术特征(2),合议组认为CD8跨膜结构域或CD28跨膜结构域均属于构建CAR中常规的跨膜结构域,同时引用的对比文件2-3也已经验证了这一观点。此外,该专利申请也没有记载任何关于选择这些跨膜结构域所带来的预料不到的技术效果。
因此合议组认为本领域技术人员有动机结合对比文件1-4并获得修改后权利要求1的技术方案。
至于预料不到的技术效果,合议组认为,由于对比文件1已经明确记载在针对CD22的cTCR中使用高亲和力的抗原结合部分可以允许肿瘤细胞的选择性裂解,因此本领域技术人员有动机选择对比文件4的HA22构建CAR从而实现选择性裂解肿瘤细胞的技术效果。换言之,该专利申请并没有达到预料不到的技术效果。
基于上面的理由,该专利申请最终被维持驳回。
TiPLaber说
第一个故事的启示
第一个故事非常有代表性地反映了CAR-T专利申请的创造性问题审查的思路。在很多时候,CAR结构的与众不同之处或者说改进之处可能就在于使用了一个特殊的抗原结合部分。在此情况下,CAR-T或者CAR的创造性实质上被转化为判断其中的抗原结合部分是否具备创造性,或者,是否使所构建的CAR具备创造性的问题。
这时,就要特别注意其所使用的抗原结合部分是否已经被记载于现有技术中,或者,能否避免使记载该特定抗原结合部分的文件成为现有技术。事实上,第一个故事中的最终重创该专利申请的对比文件4记载了HA22,而对比文件4的申请人恰恰正是美国卫生和人力服务部(也为该专利申请的申请人)。可以说是申请人本身的在先关于抗体的专利申请成为了在后申请的CAR的专利申请的绊脚石,这是一种非常让人惋惜的情况。
在现实的研发过程中,一般先获得了一个让人满意的单链抗体,再去尝试能够借助该单链抗体构建一个具有一定治疗效果的CAR。由此可见,统一的专利布局(尤其是单链抗体相关专利申请的公布时机)的规划就显得尤为重要。这个专利布局的规划必须和申请人的研发计划和研发进度紧密相连。迫切地需要研发团队和IP律师的通力合作。
此外,申请人在答复复审通知书的阶段对权利要求1进行了进一步地限定。申请人虽然限定了跨膜结构域与和胞内信号传导结构域,确实使权利要求1的范围变小了,然而,说明书中并没有任何的实施例,甚至任何的记载能够说明这些限定的技术特征与修改后的权利要求1所实现的技术效果相关。
换句话说,无法通过该专利申请记载的内容获悉这些限定的技术特征为创造性做出了贡献。从这个角度来看,上述限定式修改的意义非常有限。
尤其是在CAR的发明点落在抗原结合部分的情况下,常见的跨膜结构域和胞内信号传导结构域就很容易被审查员认为是本领域的常规选择。
由上可知,CAR-T专利申请的创造性既与抗体专利申请的创造性存在一些共通之处,也有其自身的特点,值得研究学习。
有关CAR-T专利申请的创造性问题的其他故事,我们将后续逐一介绍。
*以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
