AAV基因治疗领域新秀Regenxbio
Regenxbio是一家临床阶段生物技术公司,致力于AAV (Adeno-associated virus,重组腺相关病毒)基因疗法的开发和商业化。

Regenxbio拥有的NAV技术平台是一种专有的AAV基因递送平台,包括100多种新型AAV载体,比如AAV7、AAV8、AAV9和AAVrh10。
Regenxbio的候选产品主要使用AAV载体向细胞递送基因来纠正遗传缺陷或在体内细胞中产生治疗性蛋白质,均利用NAV技术平台开发而成。目前正在开发用于治疗视网膜、代谢和神经退行性疾病的基因治疗产品候选物。
除了进行inhouse内部开发之外,Regenxbio还将NAV技术平台许可给众多领先的生物技术公司。目前,已经有至少10家公司获得了NAV平台技术的许可并据此开发了超过20个候选产品。技术许可帮助Regenxbio更好地聚焦于内部产品线的开发并增加收入。
之前文章中提到的AveXis (已经被诺华收购)就是获得了NAV技术的许可并开发了其候选产品AVXS-101,目前AVXS-101正处于临床试验阶段并已经获得FDA的优先审评。
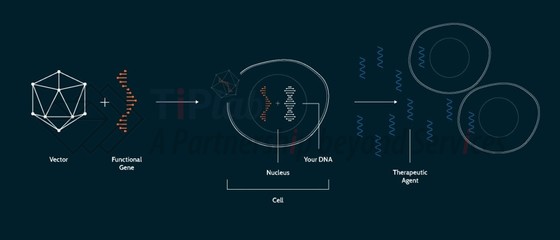
NAV技术平台
NAV载体是一种经修饰的腺相关病毒 (AAV),能够克服早期AAV载体 (AAV1-AAV6)的免疫原性等问题,此外,NAV载体本身的致病基因已经删除,因此不会在人体中引起疾病。
NAV技术平台主要优势在于:低免疫原性、容易投入生产、高且长时间的基因表达和多样化的组织特异性。
NAV技术平台包括100多种新型AAV载体,这些AAV载体可以到达身体的不同部位并发挥不同的治疗应用。例如,递送至肝脏的基因疗法具有治疗血友病等代谢疾病的潜力,而递送至中枢神经系统(脑和脊髓)的基因疗法主要治疗影响大脑和认知相关的疾病。
NAV载体是一种在体 (In vivo)基因疗法,当将感兴趣的基因(即缺失/缺陷基因或治疗蛋白基因)插入NAV载体并通过注射或输注的方式直接施用于患者后,NAV载体可以到达靶细胞并使其制造出人体所需的蛋白质。
由于基因疗法具有长期效果,因此单次使用NAV基因疗法可能具有与传统慢性疗法长期治疗等同的效果。
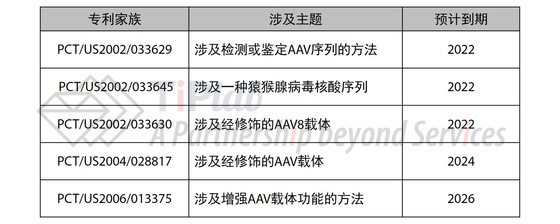
NAV技术平台的相关专利(申请)
继腺病毒载体基因疗法首个临床试验的阴霾之后,宾夕法尼亚大学 (UPenn)的James Wilson团队于2004年报道他们发现了100多种新型AAV—下一代AAV载体,这些AAV载体构成了NAV平台技术的基础。
UPenn为下一代AAV载体申请了专利保护。
2009年,Regenxbio从UPenn获得了下一代AAV载体的独占许可,其中专利资产有超过100件涵盖NAV载体的全球专利 (申请),包括涉及AAV7、AAV8、AAV9和AAVrh10的载体以及它们的制备方法和治疗用途的专利 (申请)。
这些专利家族预计最晚将于2026年到期。
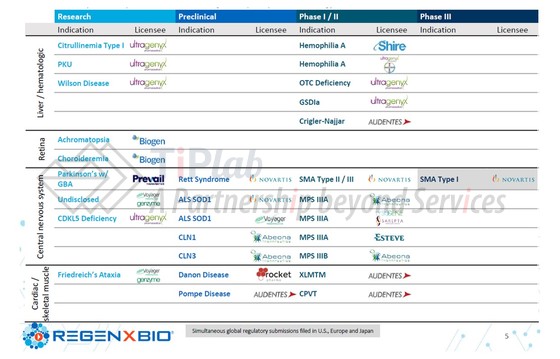
Regenxbio产品管线
Regenxbio正在开发用于治疗视网膜、代谢和神经退行性疾病的基因治疗产品候选物。

RGX-314
年龄相关性黄斑变性 (AMD)是一种潜在进展性黄斑病变,其中湿性AMD是由于新生血管生成造成过量的液体渗漏从而导致失明,湿性AMD是造成美国、欧洲和日本视力丧失的主要原因,患者人数超过200万人。
抗血管内皮生长因子 (VEGF)抗体的出现显著改善了湿性AMD的治疗效果,现已成为湿性AMD的标准疗法,不过这些疗法需要重复 (通常每四到八周的频率)的眼内注射,患者依从性差。
RGX-314是一种新型、一次性视网膜下基因疗法,其含有编码抗VEGF抗体片段的NAV AAV8载体,用于治疗湿性AMD。AAV8载体可以将基因传递给视网膜中的细胞,这些细胞就可以产生抗VEGF蛋白,以中和VEGF的活性,从而减少渗漏血管生成和积液。
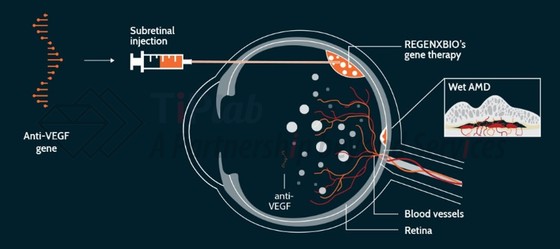
2017年5月,Regenxbio启动了RGX-314治疗湿性AMD的临床试验。
目前临床I/IIa结果显示:
在安全性方面,RGX-314的耐受性良好 (n=24),没有出现药物相关不良事件 (AE)或药物相关严重不良事件 (SAE);
在有效性方面,所有受试者均表现出剂量依赖性增加的蛋白表达,在Cohort3组中,RGX-314给药6个月后所需的抗VEGF注射次数最低且蛋白水平可以持续表达6个月。
Regenxbio将于2019年启动治疗湿性AMD的临床IIb期试验,并启动新适应症的临床研究。
涉及RGX-314的专利申请
在I期临床试验招募受试者前夕,UPenn递交了涉及RGX-314活性成分的PCT专利申请 (PCT/US2017/027529)。
同一天,Regenxbio也递交了涉及RGX-314治疗用途的PCT专利申请 (PCT/US2017/027650),权利要求1涉及:
“A method of treating a human subject diagnosed with neovascular age-related macular degeneration (nAMD), comprising delivering to the retina of said human subject a therapeutically effective amount of anti-human vascular endothelial growth factor (hVEGF) antigen-binding fragment produced by human retinal cells.”
PCT/US2017/027650的权利要求1涉及一种治疗诊断为新生血管性AMD受试者的方法,包括向所述受试者的视网膜递送治疗有效量的抗人VEGF抗体片段,而这个抗体片段是由人视网膜细胞产生的。
有趣的是,这里并没有直接限定用AAV载体进行治疗,而是限定抗体片段是由人视网膜细胞产生的。
目前这两个PCT申请正在进入不同的国家阶段,若获得授权,将于2037年到期。
RGX-501
纯合子家族性高胆固醇血症 (Homozygous familial hypercholesterolemia,HoFH)是由LDLR基因异常引起的一种单基因病。LDLR通过促进肝脏中低密度脂蛋白 (LDL)的摄取和降解来调节胆固醇。而HoFH患者由于LDLR的功能异常而导致血液胆固醇水平很高,从而可能导致动脉中斑块聚集、冠状动脉疾病或心脑血管疾病。
RGX-501是一种包载了LDLR基因功能性拷贝的AAV8载体。通过静脉注射给药,AAV8载体会到达靶器官—肝脏,并将LDLR正常基因递送给肝细胞,使这些细胞能够制造出所需的LDLR蛋白,LDLR蛋白捕获和分解低密度脂蛋白从而治疗HoFH。
2017年3月,Regenxbio开始进行RGX-501治疗HoFH的临床试验。临床I/II初期结果显示:在12周时,Cohort1组的三名受试者未显示临床有意义的LDL-C水平变化;Cohort1组受试者经历了转氨酶升高,使用皮质醇药物后好转。Regenxbio递交了修订版的临床试验方案以继续进行研究。
涉及RGX-501的专利申请
UPenn递交了涉及RGX-501活性成分的专利 (申请),比如已经获得授权的US8962330B2,其权利要求1保护一种AAV8病毒载体,包含AAV8衣壳以及连接至表达调节序列的异源基因,其中该异源基因编码LDLR。考虑专利期调整之后,US8962330B2预计将于2026年到期。
2016年,UPenn又递交了涉及RGX-501制剂的PCT专利申请—PCT/US2016/065984,目前进入美国和中国国家阶段都处于在审状态。
其它候选产品
治疗神经退行性疾病的产品管线RGX-121、RGX-111和RGX-181都是采用NAV AAV9载体,AAV9载体可以穿过血脑屏障,从而将相关基因递送至中枢神经系统。
其中一个保护RGX-111活性成分的美国授权专利US10137176B2将于2034年到期。
涉及RGX-121或RGX-111的5个PCT申请也已经于2014~2017年间递交。
Regenxbio的专利资产构建模式
针对平台技术,Regenxbio从UPenn获得了NAV技术的独占专利许可,之后通过对外许可的方式运营专利资产,赚取不菲的许可费,为内部产品管线的开发提供坚强后盾。
针对内部产品管线,围绕多个候选产品不断创建专利资产,保障产品上市后的独占权,以获取持续收益。
Regenxbio依赖于专利资产的持续维护结合其技术秘密巩固其在基因治疗领域的领先地位。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
