siRNA结构基序的专利保护
结构基序简单理解就是一种设计规则,主要包括将不同的修饰方式以特定的数量应用至siRNA的特定位置,还包括不同的寡核苷酸结构或碱基错配等设计策略。
在2005年之前,主要涉及到使用2’-核糖修饰或错配修饰等修饰策略构建结构基序,之后使用新的化学修饰技术、新的RNA寡核苷酸结构或位置/数量更为优化和细化的修饰策略等,不同公司采用的方式有其各自的特色。
早期结构基序设计
早期UMass的Phillip D. Zamore博士通过一些结构修饰降低了siRNA的脱靶效应,这一系列的设计规则称之为“Zamore Design Rules”,主要通过碱基对错配等结构设计改善脱靶问题。这一系列专利已授权给 Silence Therapeutics。
专利家族PCT/US2004/017130,主要涉及反义链的使用经取代的寡核苷酸,从而与靶标形成G:U摆动碱基对。比如,在反义链3’ 端的少于 5 个核苷酸内的至少一个核苷酸由A替换为G,从而与靶标RNA的U形成G:U摆动碱基对,siRNA和靶标的错配促进了靶标RNA从RISC复合物中释放以提高裂解效率。
专利家族PCT/US2005/029011涉及一种不对称取代的dsRNA,其中家族成员US9121018B2保护一种提高RNAi剂效率的方法,包括在反义链 5’ (AS 5’) 和正义链 3’ 末端 (S 3’)之间引入至少一个碱基对修饰,这些修饰选自错配碱基对、摆动碱基对,包含稀有核苷酸的碱基对和包含氨基嘌呤类核苷酸的碱基对,从而促进反义链相对于正义链更容易进入RISC复合物,以降低脱靶效应。
早期来自Dharmacon的Anastasia Khvorova博士也致力于降低siRNA的脱靶效应,通过使用特定位置的2’-O-烷基或错配修饰的设计策略。US7595387B2就涉及一种具有18-24个碱基对的双链寡核苷酸,分别限定了正义链的5’最末端和倒数第二个核苷酸包含2’-O-烷基修饰,反义链的5’最末端和倒数第二个核苷酸分别包含一个磷酸化修饰和2’-O-烷基修饰,且dsRNA的其他核苷酸均为2’-OH修饰,满足上述限定的dsRNA的反义链能够使靶基因沉默而脱靶基因沉默减少。
Sirna Therapeutics在早期也有一系列和结构基序相关的专利,代表性发明人为James McSwiggen,也称之为McSwiggen Patents。Alnylam通过收购Sirna Therapeutics获得了相关专利。
McSwiggen Patents涉及siRNA的正义链和反义链中2’-核糖修饰的类型和个数,包括2’-氟、2’-O-甲基和2’-脱氧修饰等。
代表性专利家族PCT/US2003/005028中授权的EP2902406B1保护一种化学修饰的合成的短干扰核苷酸,权利要求1中限定正义链和反义链中具有硫代磷酸修饰(1-10个)以及一个或多个2’-脱氧、2’-O-甲基、2’-氟和/或一个或多个通用碱基修饰,且限定核苷酸共价连接至缀合物(选自碳水化合物和蛋白质等)。该权利要求中对于缀合物的限定可以涵盖类似GalNAc的缀合物。其他专利成员中也保护了不同的结构基序。
Silence拥有保护siRNA结构基序的专利家族PCT/EP2003/008666家族。PCT/EP2003/008666家族主要涉及2’-O-甲基修饰核糖核苷酸,权利要求既涵盖“平端”的 siRNA 分子,也涵盖具有一个或多个“突出端”的分子。
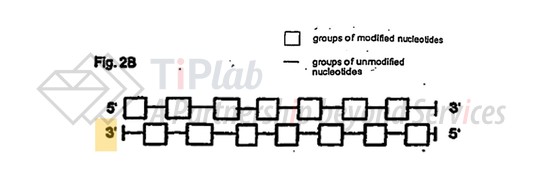
代表性的设计之一如下图,包括2’-O-甲基修饰和未修饰的核苷酸交替排列,且一条链的修饰核苷酸与另一条链的未修饰核苷酸配对。比如:EP1527176涵盖了Silence专有的AtuRNAi平台技术,即一种平端siRNA分子,其中包含交替的 2’-O-甲基修饰。AtuRNAi技术的优势在于可以提高siRNA的抗核酸酶降解的稳定性并延长其血清半衰期,同时保持治疗活性。Silence 基于AtuRNAi技术曾与 AstraZeneca以及 Quark Pharmaceuticals开展合作。
该专利家族中目前在欧洲和美国仍有专利成员处于审查阶段,已授权的四项EP专利都经历了异议,但最终都维持有效(部分修改了权利要求)。
Silence和Alnylam就这一专利家族展开了激烈的诉讼,先是Silence在欧洲对Alnylam发起多项诉讼,之后Alnylam在欧洲和美国也对Silence 提起诉讼和专利无效,最终双方以和解而告终。
2018年12月,Silence通过与 Alnylam 达成和解和许可协议以解决双方在全球范围内的专利诉讼,Alnylam 将从 Silence 获得专利许可,Silence 将有权获得基于 ONPATTRO (patisiran)从 2019 年到 2023 年在欧盟的年净销售额(0.33% 至 1.0%)的特许权使用费。
后期发展的修饰技术
Dicerna的GalXC和 GalXC-Plus技术
GalXC和 GalXC-Plus RNAi 技术是Dicerna专有的平台技术,2019 年,诺和诺德与 Dicerna 开展研究合作,利用 Dicerna 专有的 GalXC RNAi 平台技术发现和开发 RNAi 疗法。2021年,诺和诺德宣布收购Dicerna。
GalXC和 GalXC-Plus技术在过客链中添加额外的序列,包括一个四碱基序列,称为四环,旨在增强稳定性并降低对免疫系统的诱导,另外四环区域可作为各种化学递送载体的附着点,实现向不同组织递送siRNA。

其中,GalXC 技术中将四环区域与单糖 GalNAc 结合,从而实现肝脏的靶向递送。相比之下,GalXC-Plus 技术结合了新的化学修饰和各种全合成的缀合配体,能够靶向肝脏以外的组织和细胞类型中的基因,包括在中枢神经系统、肌肉组织、脂肪组织、肿瘤相关免疫细胞和其他组织中表达的靶标。
其中,临床进展最快的nedosiran(临床三期)就是利用GalXC 技术开发而成,用于治疗原发性高草酸尿症 (PH)。
GalXC和 GalXC-Plus RNAi 技术是在贝克曼研究所(City of Hope)的 John Rossi等人研究的25-30个碱基的dsRNAs (DsiRNAs,Dicer-substrate siRNAs)的基础上进行优化,相关的专利保护有PCT/US2009/006636家族,该家族在中美欧均已获得专利授权。比如,US10131912B2限定了长度为 21-50 个核苷酸的有义链和以及长度为15-22个核苷酸的反义链,且具体四环区域选自UNCG、GNRA、CUUG、d(GNNA)、d(CNNG)和d(TNCG)等特征。其他成员还保护了各种不同的结构基序特征。
Marina Biotech的UNA相关设计
Marina Biotech(从RiboTask获得)拥有包含UNA的结构基序的相关专利(现已转让给Arcturus)。在上篇文章中,我们有写到PCT/US2008/064417专利家族涉及包含一个或多个2’-3’-开环核苷酸单体(即,UNA)的单链寡核苷酸或双链寡核苷酸等。另外,PCT/US2009/066610家族则涉及UNA在寡核苷酸的位置特征。
Alnylam的ESC和ESC+技术
Alnylam已经开发了多种siRNA的结构基序,代表性的平台技术包括2014年左右开发的ESC和2017年左右开发ESC+技术,目前Alnylam已经获批的产品中大多采用ESC技术,另外,Alnylam目前也在使用ESC+技术开发新的管线。ESC+主要是在反义链的种子区域引入 GNA,可以显著减轻miRNA 样识别(即,种子区与非靶标mRNA 形成部分匹配)引起的脱靶效应并减轻肝毒性。
PCT/US2017/063078家族主要涉及ESC+技术,主要涉及在反义链种子区域热去稳定化修饰,比如:在反义链位置7引入GNA修饰。Alnylam之后还在ESC+技术的基础上进一步改进,比如使用其他的热去稳定化核苷酸来降低脱靶效应。
siRNA结构基序的专利保护特点
早期的结构设计更多使用2’-核糖修饰或错配修饰等修饰手段,这些专利预计在未来的几年内会陆续到期。
后来在临床应用时发现不同修饰的位置和数量对其siRNA的药效或药代动力学有显著的影响,因此,会涉及到更为具体的化学修饰策略,比如Alnylam的STC和ESC相关的修饰。而伴随新的化学修饰技术也发展了新的基序设计,比如Marina Biotech的UNA和Alnylam的GNA相关的设计策略。另外,除了经典的21-23 nt带有突出端的siRNA结构之外,还涉及到新的siRNA结构,比如:Dicerna的带有四环区域的GalXC设计。
在这里我们尚未穷尽不同的结构设计策略,并且相信未来随着化学修饰技术的发展和对于siRNA在临床应用中的深入理解,各家公司会开发出更多样化的结构设计规则,届时领域内的专利保护可能会更加复杂。
相关企业在开发siRNA的结构基序时,不论是构建新的平台技术还是主要借鉴已有的设计策略,都建议进行针对性的风险排查来更早掌握可能潜在的专利风险并采取应对措施。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
