药品是保障生命健康的重要商品,在医药行业中,原研药企业和仿制药企业之间的矛盾纠纷常有发生。对于原研药企业,在研发新药时,需投入大量资金、人力与时间,一款新药从立项研发到上市销售至少需要十几年的时间,中间任何一个环节失败便前功尽弃。因此,原研药企业希望通过较高的新药售价来弥补之前的研发投入并实现盈利。而仿制药企业,完成仿制药审核报批后,可以凭借低成本的优势抢占市场份额,容易造成原研药的销量与市场占比份额快速下滑。如果仿制药在原研药专利到期之前上市,会引发旷日持久的侵权诉讼案件,给双方药企和社会公众带来损失。
2020年修改后的《专利法》第76条首次从立法层面规定了药品专利链接制度。随后在2021年,《药品专利纠纷早期解决机制实施办法(试行)》(下文简称《实施办法》)等文件的颁布,标志着我国处理药品专利链接纠纷的基本依据和规则体系初步构成。
《专利法》第76条规定,药品上市审评审批过程中,药品上市许可申请人与有关专利权人或者利害关系人,因申请注册的药品相关的专利权产生纠纷的,相关当事人可以向人民法院起诉,请求就申请注册的药品相关技术方案是否落入他人药品专利权保护范围作出判决。国务院药品监督管理部门在规定的期限内,可以根据人民法院生效裁判作出是否暂停批准相关药品上市的决定。
这意味着在新制度的规定下,原研药企业,可以通过专利链接制度,在仿制药上市前就专利问题提起诉讼或请求行政裁决,防止仿制药在专利到期前上市,也能够有效避免因仿制药的提前上市导致原研药市场份额下降的情况;同时保证原研药企业对新药研发的积极性,更好地满足日益增长的医疗需求。而仿制药企业也在产品审批前,提前考虑了来自原研药企业的专利影响,避免仿制药上市后再次卷入专利纠纷,影响商业化行动。对于社会公众,前置解决专利纠纷可以降低仿制药上市后的退市风险,保证药源的稳定性,减少用药负担。
对于原研药企业,根据《实施办法》第4条规定,药品的上市许可持有人应在中国上市药品专利信息登记平台上自行登记药品的基础信息以及专利相关信息,并在信息变更生效后进行更新,以维持信息的准确。
对于仿制药企业,在提交仿制药药品上市许可申请时,需进行以下四种声明之一: (一) 中国上市药品专利信息登记平台中没有被仿制药的相关专利信息; (二) 中国上市药品专利信息登记平台收录的被仿制药相关专利权已终止或者被宣告无效,或者仿制药申请人已获得专利权人相关专利实施许可; (三) 中国上市药品专利信息登记平台收录有被仿制药相关专利,仿制药申请人承诺在相应专利权有效期届满之前所申请的仿制药暂不上市; (四) 中国上市药品专利信息登记平台收录的被仿制药相关专利权应当被宣告无效,或者其仿制药未落入相关专利权保护范围。
如果仿制药申请人提交第四类声明(中国上市药品专利信息登记平台收录的被仿制药相关专利权应当被宣告无效,或者其仿制药未落入相关专利权保护范围),原研药企业有45天的时间就申请上市药品的相关技术方案是否落入相关专利权保护范围向人民法院提起诉讼或者向国务院专利行政部门请求行政裁决。
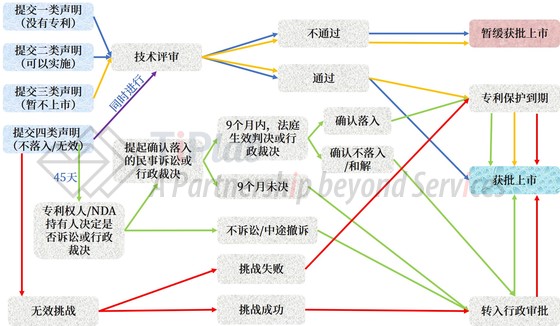
因此,在新制度下,原研药品是否有专利、是否有已登记的专利、专利有哪些;仿制药如何看待这些已经登记了的授权专利,都成为能够被集中调查的公开信息。相关信息的公开透明以及信息登记/声明的时间要求,使得原研药企业与仿制药企业潜在的专利纠纷,能够前置到仿制药上市审批程序之前来处理。
在新制度的规定下,如何更好的把握产品的商业化节奏与专利的关系,有哪些需要注意的事项呢?在后续的文章中,我们将从原研药企业的角度,探讨原研药企进行登记的要点、以及专利策略和药品专利登记的联系;从仿制药企业的角度,探讨仿制药企业明确专利风险和作出专利声明时的关注要点。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
