RNA干扰疗法扩展了“可成药”的靶点
现代药物的发现是“基于靶点”的,找到可成药靶点绝非易事。
早在20试剂90年代,研究人员首次在植物中发现了RNA干扰 (RNA interference,RNAi)现象,RNA干扰迅速成为开发基因靶向药物的重要工具。
RNAi是一种基因沉默现象,由小干扰RNA (Small interfering RNA,siRNA)通过RNA诱导沉默复合物 (RNA-induced silencing complex,RISC)而介导靶mRNA的降解。利用这一机制,RNAi可用来沉默与疾病相关的特定基因。
siRNA通常是由19-25个碱基对组成的双链寡核苷酸,随着siRNA设计算法和化学合成技术的进展,结合人类基因组测序的完成,为siRNA疗法带来了广阔的前景。
siRNA可以通过精确设计用来靶向大多数基因的mRNA转录物,也可同时靶向一个或多个基因,大大扩展了可成药的靶点。
不同于小分子和抗体,siRNA可以通过阻止致病蛋白的产生来治疗疾病,以实现从源头上对疾病进行干预和控制。
2006年,两位RNAi的先驱—斯坦福大学医学院的Andrew Fire和马萨诸塞大学医学院的Craig Mello因在真核生物中发现RNA干扰现象而获得了Nobel生理学或医学奖。
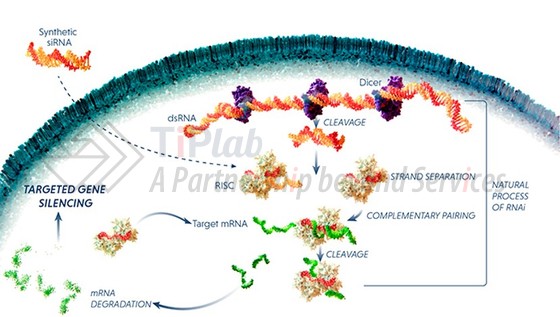
RNAi疗法的难点—靶向递送问题
在临床应用中,siRNA的安全性问题使其遭遇了一系列的挫折。
“裸”的siRNA十分不稳定,在血液循环中容易被迅速降解、不易于在靶组织中积累、且不易有效地穿过靶细胞膜到达位于细胞质中的作用位点。
因此,开发安全有效的递送系统是实现siRNA技术的关键。
在这个过程中,一些大型的制药公司逐渐放弃了RNAi疗法,大量的研究计划和合作项目被迫终止,而投资者们也因为看不到理想的结果而对这一疗法失去信心。
Alnylam一直坚持在RNAi治疗领域深耕,相继开发了两种siRNA递送技术—脂质纳米粒子递送平台和N-乙酰半乳糖胺-siRNA递送平台。
Alnylam—RNAi治疗领域的勇士
开发二代脂质纳米粒子递送系统
脂质纳米粒子 (Lipid Nanoparticle,LNP)递送系统是目前已证实最有效的siRNA递送方法之一,主要用于静脉给药。
LNP递送系统主要由四部分组成:聚乙二醇-脂质缀合物 (PEG-lipid,如PEG-DMG);可电离的氨基脂质 (Ionizable amino-lipid,如DLin-MC3-DMA);二硬脂酰磷脂酰胆碱 (DSPC)和胆固醇 (Cholesterol)。
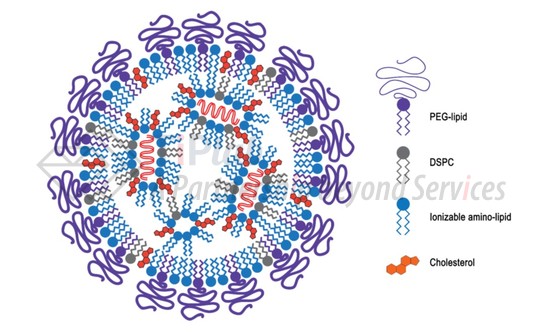
LNP外层的PEG可以起到“隐形”的作用,以降低纳米粒子被巨噬细胞清除,从而延长循环时间,并达到被动靶向的效果。
理想的可电离的氨基脂质在药物递送过程中起多重作用:与带负电荷的siRNA自组装形成反胶束结构;在生理pH下,氨基脂质表面不带电荷,以延长血液循环时间并增加靶细胞的摄取;当LNP内吞进入靶细胞的酸性核内体中,使siRNA逃脱核内体并进入细胞质中发挥作用。
Alnylam与AlCana Technologies以及不列颠哥伦比亚大学 (UCB)的科学家合作发现可电离脂质的解离常数pKa值与LNP活性 (即LNP递送siRNA进入靶细胞并引发基因沉默的能力)之间存在重要关系,并进行了系统研究。
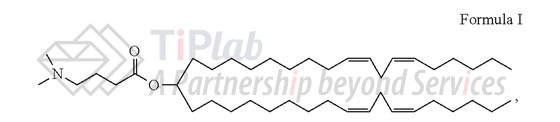
他们发现pKa值在6.2-6.5之间的氨基脂质可用于设计理想的LNP运载体。其中,基于DLin-MC3-DMA的LNP是最有效的脂质之一,他们将此研究成果发表在了Angewandte Chemie上 (DOI:10.1002 / anie.201203263),并在此之前递交了专利申请。
2010年,Alnylam同时递交了保护DLin-MC3-DMA的US专利申请 (授权公告号:US8158601B2)和PCT专利申请 (公开号:PCT/US2010/038224)。
US8158601B2的权利要求1保护一种阳离子脂质或其药学上可接受的盐,结构式如下:
接着,Alnylam递交了多个US8158601B2的延续案,其中US8802644B2的保护主题涉及脂质制剂和核酸-脂质粒子等,其中权利要求1保护一种脂质制剂,包含:DLin-MC3-DMA、一种中性脂质、一种固醇和一种PEG修饰的脂质;权利要求33保护一种核酸-脂质粒子,包含如权利要求1保护的脂质制剂和包裹在其中的治疗性siRNA。
延续案US9394234B2保护DLin-MC3-DMA的制备方法。
PCT/US2010/038224进入了EP、CN、JP等国家,其中中国的授权专利CN102625696B及其分案CN104873464B分别保护阳离子脂质DLin-MC3-DMA;核酸-脂质颗粒以及一种制备阳离子脂质的方法。
PCT/US2010/038224专利家族预计至2030年以后到期。
鉴于此,Alnylam开发了包含离子化氨基脂质DLin-MC3-DMA的二代脂质纳米粒子递送平台。
中性LNP的一个显著特点是易于通过载脂蛋白E (Apo E)介导的内吞途径富集在肝细胞中 (即所谓“内源性靶向”),因此LNP更适用于治疗肝细胞相关的疾病。
开发ESC+ GalNAc-siRNA皮下给药递送平台
Alnylam将siRNA缀合至N-乙酰半乳糖胺 (N-Acetylgalactosamine,GalNAc)形成GalNAc-siRNA缀合物,其中GalNAc配体可以结合肝细胞表达的去唾液酸糖蛋白受体 (Asialoglycoprotein receptor,ASGPR)并将siRNA靶向递送至肝细胞。因此,GalNAc-siRNA可用于开发多种肝靶向递送核酸药物,临床研究结果显示GalNAc-siRNA更适合用于皮下给药。
为了提高基因沉默效率,Alnylam还使用增强的稳定化化学(Enhanced stabilization chemistry,ESC) 技术对RNA链进行了一些修饰,并据此开发了ESC+ GalNAc-siRNA平台技术。
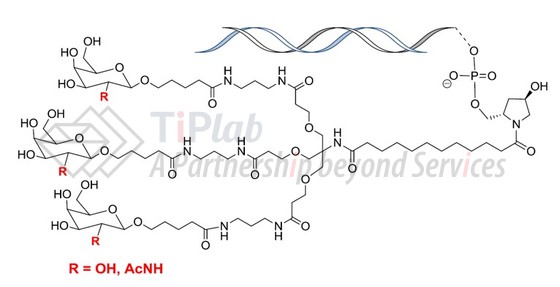
Alnylam递交了涉及GalNAc-siRNA的专利家族,比如US8106022B2的权利要求1保护一种iRNA剂,通式为:
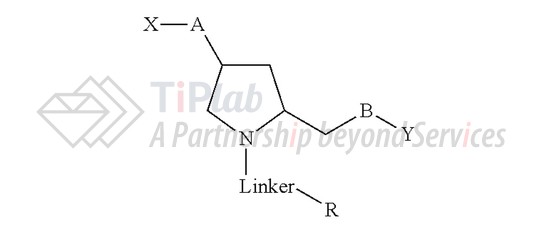
US8106022B2对各个取代基进行了定义,保护范围比较宽泛,涵盖GalNAc-siRNA。
此外,Alnylam于2012年递交了涉及经修饰的RNA的PCT国际申请—PCT/US2012/065601。
PCT/US2012/065601进入美国国家阶段的授权专利US9796974B2保护一种能够抑制靶基因表达的双链RNAi治疗剂,包含有义链和反义链,每条链具有14至30个核苷酸,并限定了一些位点的修饰。中国国家阶段的专利申请仍处于审查阶段 (CN104105790A)。
启动“Alnylam 5x15”战略计划
Alnylam于2011年启动了“Alnylam 5x15”战略计划,随着二代LNP平台和ESC+ GalNAc-siRNA平台技术的发展,Alnylam已经开发了一系列候选药物。
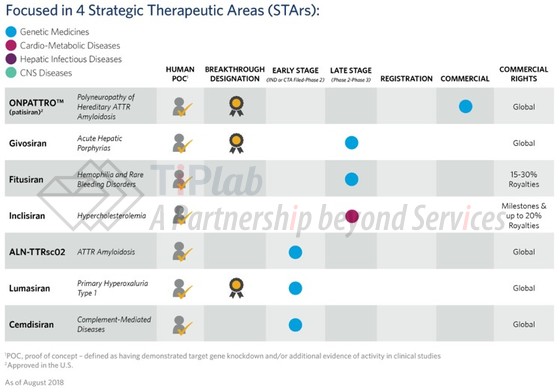
据Alnylam称,除了已获批的patisiran是采用二代LNP递送系统之外,其它候选产品均是采用ESC+ GalNAc-siRNA技术开发而成。可见,Alnylam已经将其研发重心转向皮下给药方式的GalNAc-siRNA缀合物。
首款RNA干扰疗法获批
2018年8月10日,FDA批准ONPATTRO® (patisiran)脂质纳米粒子复合物用于治疗一种罕见疾病—成人遗传性转甲状腺素 (Transthyretin,TTR)介导淀粉样变性引起的多发性神经病变。
ONPATTRO®通过静脉输注将patisiran (一种双链siRNA,可特异性结合TTR mRNA)递送至肝脏,通过RNA干扰引起TTR mRNA的降解,从而减少血清中TTR蛋白和组织中TTR蛋白沉积物。
ONPATTRO®是FDA批准的首款siRNA药物,是RNAi领域的一个里程碑事件。
递送平台助力RNA干扰疗法的应用
从1998年首次在线虫中观察到RNA干扰现象至2018年首个RNAi药物的获批,期间经历了整整20年,而正是递送平台的不断发展使其从临床走向了市场。
未来,开发先进的RNA递送平台并提高基因沉默效率将给RNA干扰疗法带来更加广阔的应用前景。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
