Strand 由麻省理工学院的合成生物学先驱(包括Ron Weiss教授)创立,其专有平台将布尔逻辑电路与 mRNA 递送相结合,以实现靶向、可控和智能的疗法。最初的重点基于自我复制的可编程 mRNA 治疗实体瘤。
如果想让免疫系统与肿瘤细胞发生作用,有两个关键点:mRNA 需要由肿瘤细胞本身表达,而且需要长时间表达。
Strand 的 mRNA 构建体将源自 RNA 病毒的自我复制基因与基因编程逻辑电路相结合,后者可控制治疗性蛋白质在患者体内的表达位置、时间和强度,从而实现精准可控的递送。例如,这种基因编程使 Strand 的 mRNA 能够感知细胞独特的miRNA 表达特征,并实现细胞类型的特异性表达。
Strand 建立了一个数据库,其中包括所有可以递送 mRNA 的不同细胞及其 miRNA 特征。然后使用计算工具和机器学习来区分这些细胞,例如,需要确保mRNA 在肝细胞中关闭,而在肿瘤细胞或 T 细胞中开启。
Strand 在多种 mRNA 模式(包括修饰、自我复制和环状 mRNA)方面具备专业知识和能力,来创造更持久的蛋白质表达和免疫反应。
Strand的首席执行官 Jacob Becraft 博士在MIT读博期间,与博士后Tasuku Kitada合作,创造了可以控制细胞内蛋白质表达的基因“开关”并获得了专利。MIT经由其技术许可办公室将专利许可给了Strand。
Strand 进展最快的管线 STX-001 利用 mRNA 进入肿瘤,然后促使肿瘤制造 IL-12。长期以来,研究人员一直将 IL-12 视为一种潜在的癌症疗法。但在 20 世纪 90 年代, IL-12 的早期试验因患者出现毒副作用而被迫停止。Strand 的科学家设计了一套“基因回路”的指令,指示 mRNA 仅在检测到肿瘤微环境时才产生IL-12。
STX-001 是一种 LNP 包裹的表达 IL-12 的自复制 mRNA,可长时间表达 IL-12 细胞因子,通过瘤内注射来促进局部 IL-12 的产生,限制 IL-12 系统性暴露和相关毒性,临床前模型已证明其具有显著的免疫调节和抗肿瘤活性。
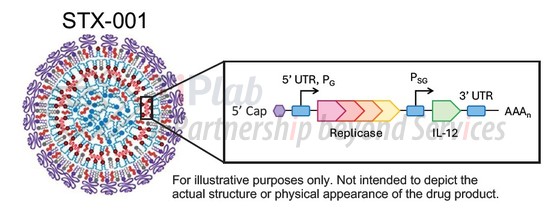
今年6月份公司在 2025 年 ASCO 年会上公布了 STX-001 针对晚期实体瘤患者(黑色素瘤和血管肉瘤)的 1 期临床初步数据,结果令人鼓舞,并指出多例患者获得了符合实体瘤疗效评价标准的缓解,并且在难治性患者中也表现出良好的安全性。
STX-003 是首个可全身给药的编码 IL-12 的自复制 mRNA,它带有可编程的基因电路,可以限制有效载荷在非靶组织中的表达,同时保留在肿瘤中的表达。已有数据表明,STX-003 可能实现IL-12 在肿瘤中的靶向表达。
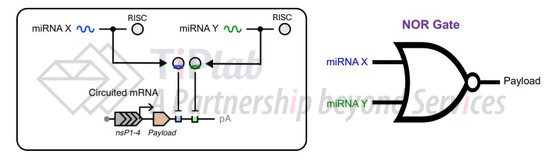
以MIT为申请人的PCT/US2015/049045家族基于 RNA 的工程合成遗传回路,其仅在转录后水平上进行调控。已授权的保护一种基于microRNA识别的合成RNA电路,限定了两个RNA分子的元件以及调控方式。
以 Strand 为申请人的专利既有涉及调控 mRNA 表达持久性或选择性的系统,也有涉及IL-12的序列或递送体系。
PCT/US2021/043214涉及包含编码IL 12的经修饰的mRNA的LNP,能够触发免疫原性细胞死亡。
PCT/US2022/011841家族涉及编码IL-12β和/或IL-12α的核苷酸。
PCT/US2022/074491涉及多核苷酸组包含编码流感非结构(NS1)蛋白的第一核酸分子和编码异源靶mRNA的第二核酸分子。流感NS1和靶mRNA的共表达使细胞中靶mRNA的表达水平和靶mRNA表达的持久性增加。
PCT/US2023/066266家族涉及包含源自委内瑞拉马脑炎(VEE)病毒的复制子的LNP,其中VEE复制子能够选择性地避免和/或减少肝脏中表达的能力。
PCT/US2024/024440涉及可用于在靶细胞中选择性表达有效载荷的合成电路,包含一个编码有效载荷的序列(包含特异性识别调节剂的传感器)和一个编码调节剂的序列(包含特异性识别标记的传感器)。
PCT/US2024/039618则涉及一种多核苷酸,包含编码有效载荷的第一区域和包含免疫细胞去靶向传感器(例如脾脏去靶向传感器)的第二区域。当传感器识别标记物时,有效载荷的表达被降低或抑制。
最近递交的专利也有涉及环状RNA的合成(PCT/US2024/056551和PCT/US2024/058456)。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
