LB Pharmaceuticals是一家临床阶段的生物制药公司,致力于开发用于治疗精神分裂症、双相抑郁症和其他神经精神疾病的新型疗法。
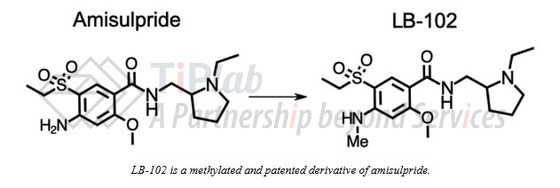
LB-102 是一种新的化学实体,是氨磺必利(amisulpride)的甲基化衍生物,目前已进入 III 期临床试验阶段,用于治疗急性精神分裂症。未来,还将开发在其他精神类疾病中的潜力,包括:双相抑郁症、重度抑郁症、阿尔茨海默病相关的躁动和精神病以及精神分裂症相关的认知障碍等。
氨磺必利(原研:赛诺菲)是一种含硫苯甲酰胺(多巴胺受体拮抗剂),属于第二代抗精神病药物,最初于 20 世纪 80 年代在法国研发,目前已在全球 50 多个国家(不包括美国)获批用于治疗精神分裂症。
据悉,当时赛诺菲曾在1998年向FDA递交上市申请,但后来撤回了申请,可能背后原因是经济因素,核心化合物专利US4401822A预计于2000年到期,公司认为专利剩余有效期内难以收回完成所有临床实验的成本。FDA于2020年批准了一种氨磺必利静脉注射剂型,用于治疗术后恶心和呕吐。
2019 年发表在JAMA 上的一篇文章分析比较了 32 种口服抗精神病药物,发现氨磺必利在减轻精神分裂症患者总体症状方面是第二有效的抗精神病药物(仅次于氯氮平),并且在减轻阳性症状方面也是最有效的。虽然氨磺必利是一种临床有效且耐受性良好的药物,但也存在一定的局限性。
LB-102 旨在提高氨磺必利的安全性和有效性:
提高BBB通透性:与其他抗精神病药物相比,氨磺必利的血脑屏障(BBB)通透性较低使其需要使用较大剂量。LB-102 在氨磺必利基础上添加一个甲基,使其更易溶于脂,从而增强了其穿过血脑屏障的能力,同时保留了对受体的效力和选择性。
降低给药剂量和频率:氨磺必利需要每日服用两次,BBB通透性的提高使 LB-102 能够每日口服一次且给药剂量降低,从而最大限度地减少副作用,改善临床疗效,并提高患者的治疗依从性。
LB 正在研究 LB-102 的替代长效注射剂型,有望为精神分裂症和双相抑郁症患者提供更好的临床疗效和治疗依从性,并延长 LB-102 的商业保护期。
体外实验发现,LB-102 与 CNS 受体的结合力与氨磺必利相似,其中,LB -102 对多巴胺 D2 和 D3 受体的结合力最强,对 5-HT7 受体的结合次之。LB-102 和氨磺必利与其他非靶向中枢神经系统受体的结合力均较弱,这些受体通常与焦虑、体重增加或代谢综合征等不良副作用相关。
采用标准体外膜通透性试验评估了 LB-102 穿过 BBB 的能力, LB-102 的通透性约为氨磺必利的 200 倍 。
据 LB 的招股书披露,截至2025年7月21日,全球共有LB约 43 项授权和在审的专利(申请)与 LB-102 相关LB,包括今年递交的5件临时申请,预计将于2026年递交正式申请。

LB-102 是在现有技术基础上进行了改构,因此想要获得一个较为宽泛的化合物通式难度较大,但即使是这样,LB也尽可能扩展其取代基的范围或尝试修改其化合物骨架。
在化合物核心专利家族PCT/US2017/063529中,已授权的范围包括化合物通式和具体化合物分子(涵盖LB-102和其N-或S-构型的异构体)及其治疗用途。其中,对于化合物通式的限定范围有多种:
LB-102骨架 + 4-氨基的取代基:CN授权范围限定取代基是烷基,而US授权范围较宽,取代基可以是烷/烯/炔基、环烷基、环烷基烷基、杂环基、杂环基烷基、芳基、芳烷基、杂芳烷基和杂芳基等,且这些取代基可以进一步被取代。
改造LB-102骨架:将吡咯烷替换为开环基团丙胺(一项US授权专利)。
改造LB-102骨架:去掉吡咯烷上的取代基(一项US授权专利)。
在效果验证的实施例中,将专利中的化合物(化合物102和/或其S-构型异构体103)直接对标氨磺必利,在膜渗透性、对受体的结合(细胞层面)和药物活性(不同的大鼠模型)方面进行了对比。
预计2042年到期的专利家族(PCT/US2022/029900)主要涉及给药方案,预计2044年到期的专利家族(PCT/US2024/050260)主要涉及减少认知障碍的方法。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
