在之前的四篇文章中我们尝试从中国专利链接制度的相关规定和已有的判例出发,尝试讨论了在当下的专利制度下,原研药企业可以如何更好的通过专利策略保护自己的产品;而仿制药企业则该如何结合专利链接的相关规定更全面地管控自己仿制药产品的专利风险,并且作出合理的专利声明。在总结篇,我们将回顾之前的内容,分别总结原研药企业和仿制药企业的关注要点。
原研药企业关注要点
对于原研药企业而言,首先需要明确可登记专利需要同时满足以下两个要件:1)专利类型满足《实施办法》第五条的规定;2)专利覆盖原研药。虽然目前药品审评中心并不会对原研登记的专利是否正确作出审查,但错误登记的专利并不能真正实现阻止仿制药的获批。所以,原研药企业需要及时调整专利策略,尽可能确保登记的专利中随时有至少一个专利是正确登记的。例如,当原研药品上市时,如果活性成分/适应症专利已经或即将到期,而细分适应症或者制剂配方的专利还处于审查阶段,则可以考虑先授权一个保护范围较小但涵盖原研产品的专利,而后续更大的保护范围可以通过分案进行争取。
其次,药品不同研发阶段将产生不同类型的专利,原研药企业需要注重挖掘临床阶段产生的可登记专利。一般而言,活性成分专利和主要的适应症专利一般在研发早期产生,到药品上市时可能保护期限已经所剩无几,而临床阶段产生的专利往往是构成原研药品长期专利壁垒的主力军。因此,原研药企业需要关注临床阶段中制剂配方和细分适应症相关专利的挖掘,这类专利是临床阶段产生的关键可登记专利。即使发明高度一般,只要能够保护的具体的产品也将对仿制药企业产生十分有效的阻止力度,此时,做好现有技术检索并制定好新创性争辩策略就尤为关键。
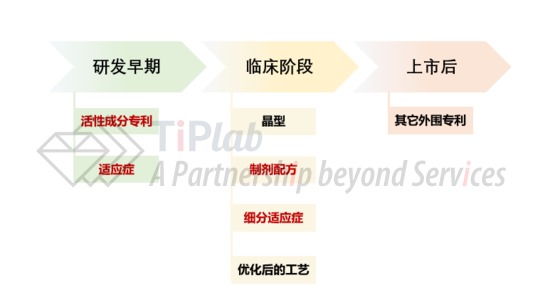
此外,原研药品专利壁垒的构建中,不可登记的相关专利以及不涵盖原研药品的外围专利的申请同样尤为重要。不可登记但涵盖原研药品的相关专利(如:晶型专利)虽然不可以通过专利链接制度阻止仿制药的获批,但仍可以在仿制药上市后提起侵权诉讼;而外围专利在一定程度上,可以增加仿制药企业和同类型创新药企业的规避的难度。
仿制药企业关注要点
对于仿制药企业而言,首先需要明确专利信息登记平台上的专利不等于自身需要考虑的全部风险专利。一方面还存在其他不可登记类型、仍处于审查阶段尚未授权或者刚授权暂未登记的相关专利等;另一方面,由于中国专利链接制度目前实施时间尚短,原研药企业对于可登记专利的规定存在理解的偏差以及药品审评中心不会对登记专利是否正确进行审查,有些不可登记的专利被错误地登记在了登记平台上。因此,仿制药企业采取应对措施时不能完全依赖于登记平台的信息,而应该通过检索掌握更为全面的相关专利列表,然后结合专利链接制度的规定对这些专利进行分类,并采取不同的处理方式。
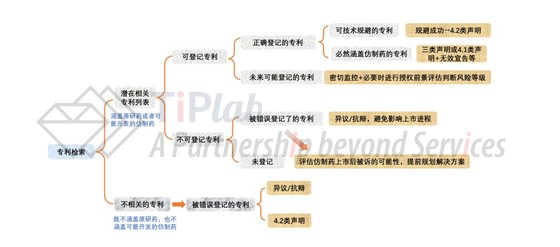
此外,我们还结合具体的案例探讨了三个目前存在争议的场景,仿制药企业该如何进行合理的专利声明:
1.对于声明在先登记在后的专利,如果原研药企业要求仿制药企业更正专利声明,则仿制药企业需要修改声明,即使仿制药企业拒绝更正,原研药企仍可能有权提起确认落入之诉。因此,仿制药企业在递交专利声明后仍需密切监控尚未登记的专利(申请)并提前规划应对措施,避免自己的商业化节奏被“后续登记的相关专利”打乱。
- 对于已被国知局宣告无效但专利权人上诉后,仍处于行政诉讼中的相关专利,法院可能会倾向于认为其不属于二类声明中的“被宣告无效”的专利,仿制药企业正确的专利声明方式应当为三类或四类声明。
当然,在这种情况下,如果仿制药企业进行了四类声明,而原研药上市许可持有人基于该四类声明发起了确认落入专利权保护范围之诉,若仿制药企业不请求法院进行实体审理,法院常见的处理方式为“先行裁驳,另行起诉”。对仿制药企业来说,进行四类声明的风险也相对比可控。
- 最后,对于3类仿制药(即仿制境外上市但境内未上市原研药品的药品)的上市申请,仿制药企业需要对相同剂型的其它规格项下已登记的专利作出专利声明,但无需对不同剂型下登记的相关专利作出专利声明。
以上是笔者对于当前中国专利链接制度对原研药企专利申请策略、仿制药企专利风险管控的影响以及仿制药企该如何更好地进行专利声明的粗浅理解。TiPLab也将持续关注专利链接制度的变化及其在生物医药领域的实践案例,以期望给读者更多启发。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
