后来居上的Eylea®
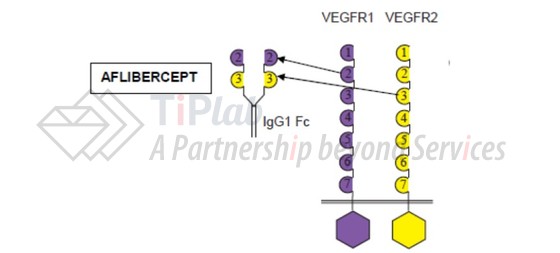
Eylea® (活性成分aflibercept)是一种重组二聚体融合蛋白,由VEGFR1 (亦称Flt-1)的胞外结构域、VEGFR2 (亦称KDR或Flk-1)的胞外结构域及人IgG1的Fc部分融合而成。Eylea®可通过结合VEGF-A以及胎盘生长因子 (PIGF)来减少血管生成并降低血管的通透性。
2011年,FDA首次批准Eylea®用于治疗新生血管性 (湿)年龄相关性黄斑变性 (AMD),此后又相继批准其用于治疗视网膜静脉阻塞后黄斑水肿 (RVO)、糖尿病性黄斑水肿 (DME)和糖尿病视网膜病变 (DR)。
Eylea®是继Lucentis® (Avastin®的姊妹药,由罗氏和诺华合作研发)之后又一款用于治疗AMD的重磅生物药。2016年,Eylea®的全球销售额已经达到了约52亿美元,而同年Lucentis®的全球销售额约为33亿美元,也就是说Eylea®在眼科疾病领域的市场份额已经超越了Lucentis®。
不过,回顾Eylea®的诞生过程,可谓一波三折。简单来说,活性成分aflibercept最初由Regeneron公司研发,然后其与Aventis (后来被Sanofi收购)合作探索aflibercept在肿瘤、眼科疾病和其它相关适应症方面的治疗性应用。然而,Aventis被Sanofi收购后,并不看好Eylea®在眼科领域的应用前景,并将aflibercept在眼科领域的开发和商业化权利退还给了Regeneron。
拿回权利的Regeneron并未放弃,而是开始与Bayer合作,继续推进aflibercept在眼科领域的应用。在Bayer助力下,aflibercept在2011年率先获得FDA的批准用于治疗AMD (即为Eylea®),由Regeneron负责美国市场的营销,而Bayer则负责美国以外市场的营销。
时隔一年,aflibercept用于肿瘤治疗的适应症也获得了FDA的批准,与FOLFIRI (5-氟尿嘧啶、亚叶酸和伊立替康)联合用于治疗转移性结直肠癌 (mCRC)。为了与Eylea®区分,将其命名为ziv-aflibercept (商品名Zaltrap®)。而2016年,Zaltrap®的全球销售额只有区区0.8亿美元,Sanofi估计为当时抛弃Eylea®的决定后悔莫及。
螳螂捕蝉 黄雀在后
这厢,Eylea®的销量节节攀升;那厢,竞争对手早已磨刀霍霍了。这位竞争对手就是Lucentis®的开发者之一Genentech (罗氏旗下公司),而这刀,就是Genentech的Davis-Smyth专利们。
我们知道,虽然都是靶向VEGF的,但Genentech参与开发的Lucentis®是一款单抗类生物药,而aflibercept是一款融合蛋白,按理说两者应该井水不犯河水。然而,Genentech不仅申请了保护Lucentis®的专利,还颇有先见之明地递交了保护VEGF受体蛋白的专利申请,并获得了授权。Aflibercept恰好落入了这些专利的保护范围。
在Eylea®即将上市时,Regeneron和Genentech就开始了专利战。起初,Regeneron声称其与VEGF Trap (即为aflibercept)相关的任何活动都不侵犯Genentech的相关专利权。随后,Genentech针锋相对地进行反击,声称Regeneron与VEGF Trap的相关行为已经或即将侵犯其专利权。
Genentech的这一系列相关专利被称为Davis-Smyth专利,由Davis-Smyth等作为发明人,包括四个保护VEGF受体蛋白的专利,分别为US6100071A、US6383486B1、US6897294B2和US7771721B2。
下面,我们来看看Davis-Smyth专利们究竟保护了什么。
US6100071A保护一种VEGF受体蛋白,于2000年获得授权,权利要求1长这个样子:

US6100071A的权利要求1很长,在这里我们只截取了一部分,其要求保护“一种VEGF受体蛋白质,其能够结合VEGF从而对其发挥抑制作用,所述VEGF受体蛋白包含由酪氨酸激酶受体衍生的免疫球蛋白样结构域1、2和3……”,并对所述免疫球蛋白样结构域1、2和3分别进行了具体限定。
US6383486B1保护一种治疗用途,于2002年获得授权,权利要求1长这个样子:

可见,US6383486B1的权利要求1中也将嵌合VEGF受体蛋白限定为“包含flt-1受体和/或KDR受体的免疫球蛋白样结构域1、2和3”。
US6897294B2是另一个保护嵌合VEGF受体蛋白的专利,于2005年获得授权,其权利要求1长这个样子:

与前面两个专利相比,US6897294B2的保护范围更宽,其仅要求嵌合VEGF受体蛋白包含来自两种或更多种不同VEGF受体分子的免疫球蛋白 (Ig)样结构域, 并且该嵌合VEGF受体蛋白包含flt-1受体或KDR受体的Ig样结构域2。很明显,aflibercept落入了该权利要求的范围内。
US7771721B2保护一种治疗用途,于2010年获得授权,其权利要求1长这个样子:

可见,US7771721B2实际上涉及US6897294B2中的嵌合VEGF受体蛋白用于抑制血管形成或血管生成的医药用途。相应地,使用Eylea®应该也落入了该权利要求的范围。
在Eylea®获批后不久,Regeneron和Bayer就与Genentech达成了和解,取得了Davis-Smyth专利的非独占许可,并承诺在Davis-Smyth专利到期前向Genentech支付一定比例的销售额作为许可费。具体而言,当Eylea®在美国的累计销售额达到4亿美元时,Regeneron需向Gententech支付0.6亿美元的款项,并随着累计销售额的提高增加支付额。随后,Genentech又追加了三项Davis-Smyth专利,双方就和解协议进行了修正,将许可费所基于的销售额扩展至了全球范围。
当然,在Eylea®的兄弟Zaltrap®即将获批前,Genentech同样发起了针对Regeneron和Sanofi的侵权诉讼,最终的结局与Eylea®相同,Regeneron和Sanofi承诺当Zaltrap®的累计销售额达到2亿美元时向Genentech支付0.19亿美元的许可费,并随着销售额的提高增加支付额。
放眼未来的专利布局助力Genentech
围绕aflibercept发生的故事再次表明,面向未来、对关键技术进行密集的专利保护有多重要。一旦发现了一种有潜在价值的技术方案,不论自己以后是否会将其商业化,都有必要进行专利保护。这无疑将加固自己的护城河,从而在竞争中扩大优势、挽回劣势。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
