首款抗肿瘤血管生成药物—Avastin®
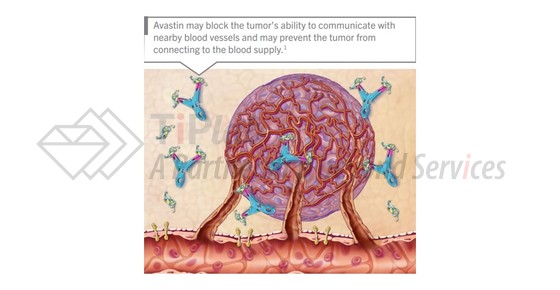
贝伐单抗(Bevacizumab,商品名:Avastin®)是罗氏(Roche)旗下基因泰克(Genentech)开发的一种重组人源化单克隆抗体,能够通过特异性结合并阻断VEGF(血管内皮生长因子),以抑制肿瘤血管生成,是世界上第一款抗肿瘤血管生成药物。与作用于肿瘤细胞增殖的传统化疗药物不同,Avastin®靶向肿瘤赖以生存的血管,以达到阻止肿瘤生长的目的。2004年2月,FDA首次批准Avastin®用于治疗转移性结直肠癌。最近一次获批是在2016年12月,FDA批准Avastin®与化疗[卡铂(carboplatin)+紫杉醇(paclitaxel),或卡铂+吉西他滨(gemcitabine)]联合治疗后,继续采用Avastin®单药治疗这一模式,用于铂敏感复发性上皮性卵巢、输卵管或原发性腹膜癌症女性患者的治疗。至今,获得FDA批准的Avastin®适应症还包括不可切除、局部晚期、复发或转移性非鳞状非小细胞肺癌,胶质母细胞瘤,转移性肾细胞癌,持续、复发或转移性宫颈癌和铂耐药的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌。欧盟EMA批准的适应症包括转移性结直肠癌,转移性乳腺癌,晚期非小细胞肺癌,晚期或转移性肾癌,晚期或复发性卵巢癌、输卵管癌或原发性腹膜癌和持续、复发或转移性宫颈癌。目前,中国CFDA已批准Avastin®用于治疗转移性结直肠癌和晚期、转移性或复发性非小细胞肺癌。
1989年,基因泰克的科学家Ferrara和他的同事们首次分离和克隆了血管内皮生长因子,并提交了专利申请(授权专利号:US5332671)。接着他们研究了VEGF的生物化学和分子生物学性质。1993年,Ferrara报道抗VEGF单克隆抗体可以在体内抑制多种肿瘤细胞的生长,表明通过抑制VEGF诱导的血管生成对于恶性肿瘤的治疗具有一定的价值。1997年,基因泰克的科学家们进一步设计了人源化的抗VEGF单克隆抗体(即为现在的Avastin®),其包含人源的骨架区和鼠源的互补决定区。2004年2月,FDA基于一项随机双盲III期临床研究试验批准了Avastin®用于治疗转移性结直肠癌。上市次年,Avastin®就获得了16.64亿瑞士法郎(合16.76亿美元)的销售额,并且随着销量的逐年稳步增长,其2016年的销售额已经达到了67.83亿瑞士法郎(合68.33亿美元)。可以说,Avastin®从诞生到被批准上市都是由基因泰克一手操办的。2009年3月,基因泰克被罗氏以大约468亿美元收入囊中,成为了罗氏的子公司。
专利权对于药物产品的重要性不言而喻,作为罗氏最畅销的药物之一,Avastin®的专利保护情况在一定程度上决定了其未来的市场表现,尤其是在核心专利到期后,罗氏还为阻止竞争对手预先布下了哪些局呢?下面让我们来一起探讨一下基因泰克(下文一致使用基因泰克)围绕Avastin®构筑的专利壁垒。
围绕Avastin®构筑的专利壁垒
美国
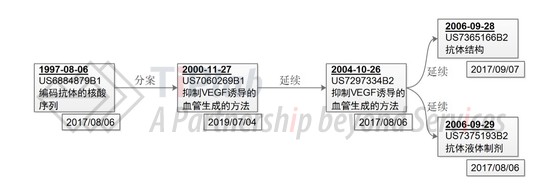
在美国,基因泰克于1997年递交了第一个保护贝伐单抗的核心专利申请,并获得授权(US6884879B1),该专利权利要求保护编码人源化抗VEGF抗体及其变体的核酸序列。由于基因泰克递交的针对US6884879B1的专利期限延长(Patent Term Extension,PTE)请求被USPTO拒绝了,因此该专利的保护期仅至2017年8月6日。2000年11月,基因泰克递交了US6884879的分案申请并获得了授权(US7060269B1),该专利保护使用抗体抑制VEGF诱导的血管生成的方法,保护范围内涵盖了所有与VEGF诱导的血管生成相关的疾病。US7060269B1获得了697天的专利期限调整(Patent Term Adjustment,PTA),从而将Avastin®这一产品的专利保护期延长至2019年7月4日。随着对药品的继续研究和开发,基因泰克又陆续递交了源自US7060269B1的多个延续申请(Continuation Application),分别保护抑制VEGF诱导的血管生成的方法(抗体序列不同于母案)、抗体液体制剂和抗体分子,这些专利都将在2017年到期。
2002年9月,基因泰克递交了针对抗体变体的专利申请并获得了授权(US7169901B2),该专利保护人源化抗体变体,保护期至2019年3月23日。为了进一步加强专利壁垒,基因泰克于2005年7月又递交了与抗体制备方法相关的专利申请并获得授权(US8008447B2),具体保护一种抗体晶体的生产方法,从而将Avastin®这个产品的专利保护期延长至2025年11月4日。
接着,在2007年6月,基因泰克申请了治疗方法相关的专利,授权专利号为US7622115B2。US7622115B2的权利要求保护施用有效量的贝伐单抗并在治疗期间评估患者胃肠道穿孔程度来治疗癌症的方法,涵盖的适应症范围相当广。该专利将Avastin®这个产品的专利保护期延长至2024年5月28日,是继2019年的一大波重要专利到期后阻止竞争对手的又一专利利器。不料,2016年9月,Hospira向美国专利审判及上诉委员会(PTAB)递交了一份双方复审程序(IPR)的请愿书,挑战该方法专利US7622115B2的有效性。Hospira专注于输液产品的研发,2015年9月被辉瑞收购。2017年3月16日,PTAB接受了Hospira的IPR请求并开始审理。有趣的是,Hospira十分热衷于挑战罗氏的专利,就在2017年3月15日,PTAB刚接受了Hospira提交的关于US7807799B2(涉及罗氏另一款抗癌产品Herceptin)的IPR请求,该专利保护一种抗体纯化的方法。
欧洲和中国
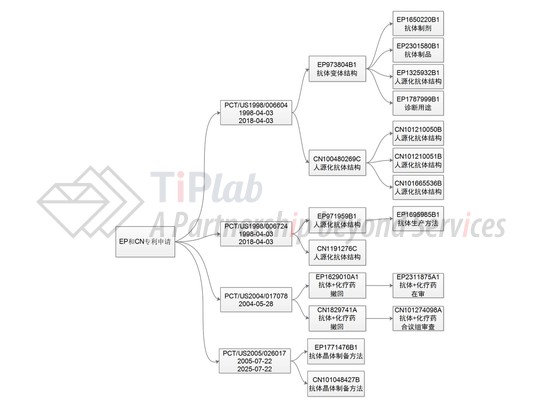
接下来,让我们看看欧洲和中国市场的专利保护情况。基因泰克在这两个地区的专利申请特点是采用PCT申请进入国家阶段的方式。基因泰克于1998年4月同一天递交了两份PCT专利申请:PCT/US1998/006604和PCT/US1998/006724。其中,PCT/US1998/006604分别进入了欧洲和中国,并获得了授权(EP973804B1和CN100480269C),该专利保护人源化抗体分子。随后,基因泰克又递交了EP973804B1的一系列分案申请,分别保护抗体制剂、抗体制品、人源化抗体结构和抗体的诊断用途。同样,基因泰克也递交了CN100480269C的一系列分案申请来保护不同的抗体结构,其中一个分案申请CN101665536B涉及多种抗体变体的结构。另一方面,源自PCT/US1998/006724的这一族也进入了欧洲和中国,并且随后也获得了授权(EP971959B1和CN1191276C),这一族专利同样保护人源化抗体的结构。其中,基因泰克还递交了源自EP971959B1的分案申请并获得了授权(EP1695985B1),该专利保护抗体的生产方法。这一系列专利都将在2018年4月3日到期。
2004年5月,基因泰克针对联合疗法递交了PCT申请(PCT/US2004/017078),该申请进入欧洲和中国国家阶段后,都处于撤回的状态。不过,随后基因泰克又分别递交了相应的分案申请,目前都处于在审阶段。若能够顺利获得授权,便能够使Avastin®这一产品在中国和EPC相关成员国的专利保护期延长至2024年5月28日。
虽然杀伤力不及保护活性成分或医药用途的专利,保护制备方法的专利也是种十分重要的外围专利保护类型,基因泰克于2005年7月递交了保护制备方法的PCT专利申请PCT/US2005/026017,该申请随后进入欧洲和中国,并相继获得授权(EP1771476B1和CN101048427B),均保护一种抗体晶体的制备方法,该专利将于2025年7月22日到期。
可见,Avastin®在美国、欧洲和中国的核心专利分别将于2018至2019年间到期,相应地,仿制药公司们已经紧锣密鼓地准备起来,要在相关专利到期后抢占Avastin®的市场份额。据我们了解,2016年11月,美国生物技术巨头安进(Amgen)与合作伙伴艾尔健(Allergan)已向FDA递交了Avastin®的生物类似药ABP 215的生物制品许可申请(BLA)。时隔一个月后,双方也已向EMA递交了ABP 215的上市许可申请(MAA)。
基因泰克与安进的“专利舞蹈”将继续
“生物制品价格竞争与创新法案”(BPCIA)提供了一个解决围绕生物仿制药专利纠纷的程序,具体规定在42 USC § 262(l)中,这个程序称为“专利舞蹈”。
故事始于2017年1月4日,FDA接受了安进提交的针对ABP 215的生物类似药上市申请(aBLA,Abbreviated Biologic License Application)。接着,安进根据第42 USC§262(l)(2)(A)款的规定在20天内告知基因泰克并提供了生物类似药上市申请的副本,但没有提供BPCIA规定的“描述用于制造生物制品过程的信息”。因此基因泰克公司于2017年2月15日在美国特拉华州地区法院对安进提起诉讼,声称安进未能遵守“专利舞蹈”规定的信息交换过程的要求,比如未能提供有关ABP 215制造过程的信息(违反第42 USC§262(l)(2)(A)款的规定)以及拒绝基因泰克的外部专家审查其生物类似药上市申请(违反第42 USC§262(l)(1)(C)款的规定)。基因泰克请求法院强制安进公司遵守BPCIA的相关规定,并延迟第42 USC§262(l)(3)(A)款规定的提供专利清单的60天期限,直到安进公司提供法定要求的信息。
2017年3月1日,美国特拉华州地区法院法官Sleet驳回了基因泰克的诉讼请求。之后,基因泰克于3月24日向安进提供了一份专利清单,包含潜在被侵权的专利和有意向安进许可的专利,双方还将继续“专利舞蹈”程序。作为“先行者”,基因泰克与安进之间的“专利舞蹈”,将为后来者提供有价值的参考。
中国相关仿制药红红火火
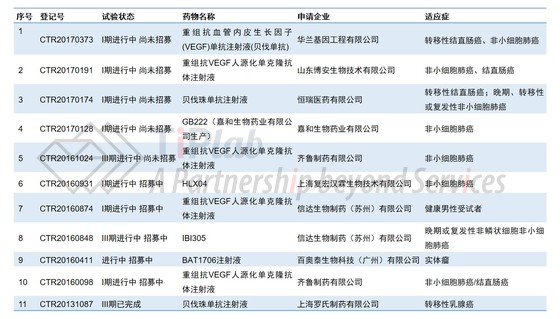
随着Avastin®核心专利即将到期,国内的药企也都摩拳擦掌,希望赶上这波浪潮。例如,华兰基因、博安生物、恒瑞医药、齐鲁制药、信达生物、复宏汉霖、百奥泰等都正进行相关的临床实验,针对的适应症大都是非小细胞肺癌和结直肠癌。其中,齐鲁制药和信达生物两家公司针对非小细胞肺癌的临床试验已进行至临床III期,双方之间的较量也已进入到冲刺阶段。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
