首款获批的CDK4/6抑制剂Ibrance
Ibrance®(通用名:palbociclib,哌柏西利,中文商品名:爱博新®)是一种口服靶向性细胞周期蛋白依赖性激酶4/6(CDK4/6)抑制剂。
CDK4/6是细胞周期的关键调节因子,能够触发细胞周期从生长期(G1)向DNA复制期(S1)转变,在许多癌症中均过度活跃,导致细胞增殖失控。在绝经后激素受体阳性(HR+)乳腺癌中,CDK4/6的过度活跃非常频繁,而CDK4/6是ER信号的关键下游靶标。
内分泌治疗是HR+/ HER2-(人表皮生长因子受体2阴性)乳腺癌的标准疗法,其中芳香化酶抑制剂(AI)是首选的一线方案。然而,绝大多数患者在治疗后都会出现内分泌抵抗和疾病进展情况,因此延长或重建内分泌治疗敏感性是一个重要的治疗思路。
临床前数据表明,CDK4/6和ER信号双重抑制具有协同作用,并能够抑制G1期HR+乳腺癌细胞的生长。CDK4/6抑制剂能有效地克服或延迟内分泌抵抗的出现,为HR+/HER2-晚期乳腺癌患者争取更多的生存时间。
Ibrance®能够选择性抑制CDK4/6,恢复细胞周期控制,阻断肿瘤细胞增殖。
2015年2月3日,美国食品与药品管理局(FDA)加速批准Ibrance® (palbociclib)联合来曲唑作为一线方案用于绝经女性ER^+(雌激素受体阳性)/HER2-^晚期乳腺癌的内分泌治疗。在此之前,Ibrance®已获得突破疗法认证和优先审评资格。
2016年2月,Ibrance®获FDA批准扩大适应症,联合阿斯利康肿瘤药物Faslodex®,用于接受内分泌治疗后病情进展的HR+/HER2-晚期或转移性乳腺癌女性患者的治疗。
2018年7月,国家药品监督管理局批准Ibrance®(爱博新®)用于HR+/HER2-的局部晚期或转移性乳腺癌,与芳香化酶抑制剂(AI)联合使用作为绝经后女性患者的初始内分泌治疗。
今年4月4日,Ibrance®又获得FDA批准用于男性乳腺癌,成为了全球首个可以用于男性乳腺癌的CDK4/6抑制剂。这项批准并不依赖于临床研究,而是基于详细说明该药实际使用情况的电子健康记录(electronic health records,EHRs)以及上市后在男性患者中用药的真实世界数据(Real-World Data,RWD)。
至此,该药物已在90多个国家获得批准。作为全球首个上市的CDK4/6抑制剂,Ibrance®在乳腺癌市场表现抢眼,2017年业绩为31.26亿美元,2018年全球业绩达41.18亿美元。
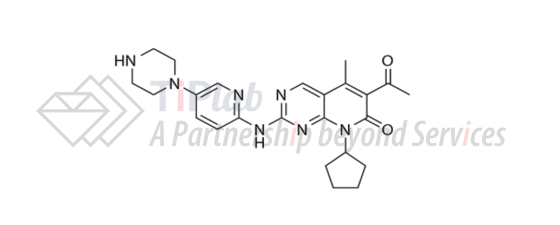
Ibrance活性成分
Ibrance®有效成分为哌柏西利(palbociclib)。Palbociclib的分子式为C24H29N7O2,分子量为447.54 Dalton。化学结构如下:
Ibrance制剂
FDA批准的Ibrance®制剂包含75 mg,100 mg和125 mg共三种规格的硬胶囊,推荐起始剂量为125 mg。辅料包含微晶纤维素、乳糖水合物、羟基乙酸淀粉钠、胶体二氧化硅、硬脂酸镁和明胶这些无活性的成分。
围绕Ibrance的专利申请
活性成分专利家族
2003年1月,Warner-Lambert公司(2000年被辉瑞收购成为其子公司)于同一日递交了涉及活性成分的美国专利申请(授权公告号:US6936612B2)和PCT专利申请(PCT/IB2003/00059),要求了一个美国临时申请的优先权。
US6936612B2的权利要求涉及一种化合物:6-乙酰基-8-环戊基-5-甲基-2-(5-哌嗪-1-基-吡啶-2-基氨基)-8H-吡啶并[2,3-d]嘧啶-7-酮,及包含该化合物的药物组合物。保护范围涵盖palbociclib。
PCT/IB2003/00059进入了包括EP、JP、CN等多个国家或地区,其中进入中国国家阶段的授权专利为CN101001857B。权利要求1涉及多种化合物,包含US6936612B2中涉及的化合物。
以CN101001857B为母案,Warner-Lambert提出了两个中国分案,授权公告号分别为CN101906104B和CN102295643B,两者均涉及通式为下列式I的化合物或其药学上可接受的盐,分别限定了不同的取代基:
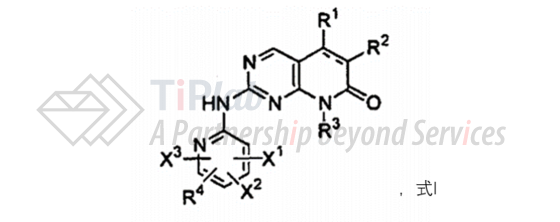
其中分案CN101906104B的独立权利要求5还涉及化合物在制备用于治疗哺乳动物由异常细胞增殖引起的障碍或病症的药物中的用途。
以US6936612B2为母案,Warner-Lambert获得延续案US7208489B2和US7456168B2。其中,US7208489B2涉及通式为式I的化合物及其药学上可接受的盐,US7456168B2涉及使用通式为式I的化合物治疗哺乳动物乳腺癌的方法。
可以看出,这些专利分别对结构通式以及具体化合物结构进行了很好的保护。辉瑞先递交针对palbociclib结构式的专利申请,再采用分案或者延续案的方式对包含不同种类取代基的结构通式或其治疗用途进行了保护,不断扩大整个专利家族的保护范围,以实现专利对产品保护的最大覆盖。
在不考虑专利期调整等因素时,US6936612B2专利家族至少将于2023年1月到期。
晶型专利家族
在活性成分家族之后,Warner-Lambert和辉瑞还递交了多个涉及palbociclib晶型的专利家族。比如:
2004年6月,Warner-Lambert递交了PCT专利申请(PCT/IB2004/002152,涉及palbociclib的羟乙基磺酸盐形式或其制备方法,或其用于治疗哺乳动物异常细胞增殖引起的疾病或病症的方法。PCT/IB2004/002152进入中国国家阶段的授权专利为CN1835951B,独立权利要求1涉及化合物的单-羟乙基磺酸盐,从属权利要求分别使用粉末X射线衍射、拉曼光谱和DSC热谱对晶型进行了限定。
同一日Warner-Lambert还递交了美国专利申请(授权公告号US7345171B2),涉及化合物的羟乙基磺酸盐晶型的制备方法。其延续案US7863278B2则涉及化合物晶型,使用粉末X射线衍射、拉曼光谱和DSC热谱对晶型进行了限定,范围与同族的中国专利不同。
2014年2月,辉瑞还递交了涉及palbociclib的结晶游离碱或其治疗用途的专利家族PCT/IB2014/058865,目前在多个国家阶段处于审查状态。
这些晶型专利家族不仅可以阻挡竞争对手,还为以后可能开发更新版本的药物做准备。
制剂专利家族
2016年5月,辉瑞还递交了涉及palbociclib制剂的专利家族PCT/IB2016/053040,进入中国的在审专利申请为CN107666914A,其权利要求1涉及“一种固体剂型,其包含约10 Wt%至约35 wt%的帕博西尼、约5 wt%至约25 wt%的选自 琥珀酸、苹果酸和酒石酸的水溶性酸及药学上可接受的载体。”,虽然这一制剂方案与已经获批的制剂有所区别,不过可以看出辉瑞还在不断优化palbociclib的剂型方案。
差异化竞争策略助推重磅药诞生
辉瑞瞄准晚期乳腺癌这一领域,研究新的发病机制,推出了首个CDK4/6抑制剂。另外,辉瑞还利用真实世界数据帮助加速药物审评,这些商业和研发方面的考虑都为其日后成为重磅药埋下伏笔。
在专利构建方面,辉瑞围绕其研发进程不断布局专利申请,这也为其制定合理的竞争策略提供保障。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
