Gilenya®(Fingolimod,芬戈莫德)由日本Yoshitomi(现更名为Mitsubishi Tanabe Pharma)公司发现,诺华(Novartis)于1997年获得了该药全球开发和日本共同开发的权力。该药是目前唯一一款同时覆盖儿童、青少年和成人患者多发性硬化症的口服药物。
芬戈莫德是一种神经鞘氨醇1-磷酸受体调节剂(Sphingosine-1-phosphate receptor-1 Modulator),具有亲脂性的芬戈莫德经口服吸收进入中枢神经系统后,通过sphingosine kinase 2(鞘氨醇激酶2)快速磷酸化,得到生物活性物质(S)-Fingolimod-phosphate,能与淋巴细胞表面的S1P受体结合,改变淋巴细胞的迁移,促使细胞进入淋巴组织,阻止其离开淋巴组织,从而减少自身反应性淋巴细胞再次进入循环的概率,防止这些细胞浸润中枢神经系统,并达到免疫调节的效果。
2010年9月,Gilenya®获美国FDA批准用于治疗多发性硬化症,接着依次被欧盟(EMA)、日本(PDMA)批准上市。
2019年7月,获国家药品监督管理局(NMPA)批准,用于治疗10岁或10岁以上患者的复发型多发性硬化(RMS)。

诺华2019年第二季度报显示,芬戈莫德在第二季度全球实现销售收入8.25亿美元。
Gilenya®活性成分
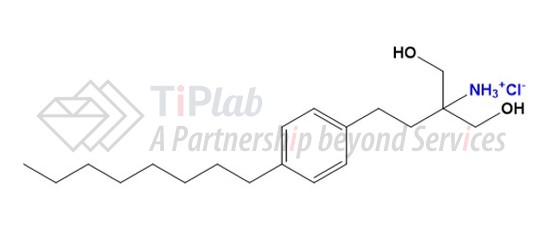
Fingolimod hydrochloride的分子式为C19H34ClNO2,相对分子质量为343.93 Dalton。化学名称为2-氨基-2-[2-(4-辛基苯基)乙基]-1,3-丙二醇盐酸盐。化学结构如下:
Gilenya®制剂
Fingolimod为白色或类白色粉末,易溶于水和乙醇,可溶于丙二醇。其口服胶囊制剂有两种规格,分别为0.5 mg和0.25 mg。
0.5 mg胶囊含有以下非活性成分:明胶,硬脂酸镁,甘露醇,二氧化钛,氧化铁。
0.25 mg胶囊含有以下非活性成分:明胶,羟丙基-β-环糊精,羟丙基纤维素,硬脂酸镁,甘露醇,二氧化钛,氧化铁。
围绕Fingolimod的专利申请
Yoshitomi与Novartis围绕芬戈莫德,除了早期布局的活性成分专利外,还递交了涉及制剂、晶型、用途的PCT申请,并进入了包括US、EP、JP在内的多个国家。
值得注意的是,随着2018年芬戈莫德获批用于10岁及以上儿童及青少年MS的治疗,为该药赢得了儿科独占(PED),即是在现有专利/独占期基础上均延长6个月,在该期间内FDA不受理或不批准其它仿制药的上市申请。
活性成分专利家族
1993年10月,Yoshitomi首先递交了涉及活性成分的PCT专利申请(PCT/JP1993/001515)。
PCT/JP1993/001515进入美国国家阶段的授权公告号为US5604229A,权利要求1保护一种通式化合物,并对取代基进行了马库什限定,保护范围涵盖芬戈莫德盐酸盐(化合物29)。权利要求1如下:

该专利于1997年2月18日授权(1995年6月8日之前递交的美国专利申请,专利保护期限为授权之日加17年),加上5年专利调整期,其到期日为2019年2月18日;另加上FDA批准的PED独占期,在现有专利的基础上又延长了6个月,该专利最终到期日为2019年8月18日。
Gilenya®首次获批在2010年,彼时其活性成分专利US5604229A的保护期限已剩不多,诺华则通过PED市场独占期尽量延长其独占期。
制剂专利家族
虽然诺华为其活性成分专利做了很多努力,但是仍然没有阻止该专利的到期,为了增强市场的竞争力,它将目光转至制剂专利。
诺华分别于2004年和2012年递交了涉及芬戈莫德制剂专利的PCT申请,分别为PCT/EP2004/003656与PCT/US2012/031340。
诺华首先开发了0.5 mg口服制剂,并递交了PCT/EP2004/003656,进入了包括US、CN、EP、JP在内的多个国家,申请专利近100篇。其中,进入美国国家阶段的衍生而来的专利申请共有9篇,其中一个美国专利申请获得了授权—US8324283B2,其权利要求1涉及芬戈莫德及其盐的口服固体组合物,涵盖FDA获批的0.5 mg口服制剂。该专利预计将于2026年9月到期。
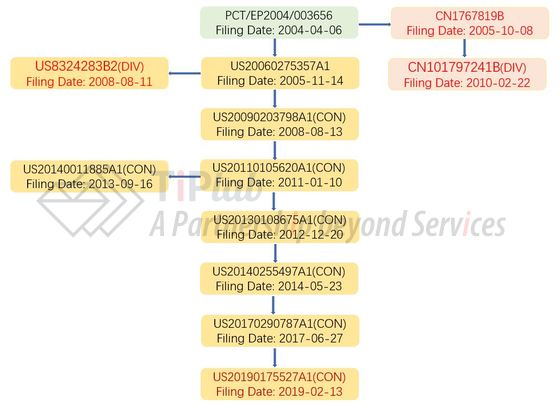
PCT/EP2004/003656进入中国国家阶段授权专利CN1767819B涉及芬戈莫德的药物制剂,其分案CN101797241B涉及制备芬戈莫德制剂的方法。
诺华接着又开发了另一种口服制剂,递交了另一个PCT专利申请—PCT/US2012/031340,其进入美国国家阶段授权专利US9592208B2涉及芬戈莫德药学上可接受的盐及其磷酸盐衍生物的口服固体组合物,涵盖FDA获批的0.25 mg口服制剂。该专利预计将于2032年9月到期。

根据各个国家制剂专利审查程序的特点,诺华递交的多个制剂申请的保护范围不均相同,殊途同归,在各个国家均获得了涵盖技术核心的授权范围。
制剂专利申请的时机可根据研究进展的推进情况或分析竞争对手研究状况,合理选择申请时机,以起到打击竞争对手的目的。
从fingolimod的例子可以看出诺华选择在不同研发阶段先后构建了上述两个庞大的PCT家族,这些关键的制剂专利打破了活性成分专利到期的“死局”,将芬戈莫德的专利生命延续到2032年,这也是诺华制剂专利布局策略的又一次成功。
用途专利家族
2007年6月,诺华递交了涉及芬戈莫德治疗用途的PCT专利申请(PCT/EP2007/005597)。
PCT/EP2007/005597进入美国国家阶段的授权专利为US9187405B2,其权利要求1保护一种减少或预防或减轻复发缓解型多发性硬化症的方法,包括向患者施用芬戈莫德。

诺华依靠制剂专利编织的专利网络
Fingolimod的例子可以说是依靠制剂专利维持产品竞争优势的经典案例。新药专利申请通常会形成一个专利保护网络,从化合物活性成分专利到制剂专利的申请时间跨度可达几年乃至十几年,得以延长药品的生命周期。
值得注意的是,核心专利到期,不等于与药品有关的所有专利都到期,仿制仍然可能存在侵犯某些专利的风险。在仿制药立项阶段,稳中求胜的企业都会提前对原研药的所有相关专利申请进行侵权风险分析,跟踪可能带来风险的专利申请的法律状态,以合理安排研发和商业化进程。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
