Vitrakvi®获得FDA加速批准
Larotrectinib (代号:LOXO-101)是Loxo Oncology和Bayer (拜耳)合作开发的一种中枢神经系统活性的TRK (Tropomyosin receptor kinases,原肌球蛋白受体激酶)抑制剂。
NTRK (Neurotrophic receptor tyrosine kinase)基因融合属于染色体改变,其结果会产生构象激活的异常TRK融合蛋白,作为一种肿瘤驱动因子,在肿瘤细胞系中可促进肿瘤细胞的增殖和存活。
NTRK融合存在于成人和儿童的多种类型的肿瘤中。在支持此次获批的临床试验中,larotrectinib在多种独特的肿瘤类型中显示了临床获益,包括肺癌、甲状腺癌、黑色素瘤、结肠癌、软组织肉瘤和婴儿纤维肉瘤等。
在前55名NTRK融合阳性癌症患者入组的临床试验中,larotrectinib的总体缓解率(ORR)达到了75% (N=55),其中22%的患者达到完全缓解 (CR)。
基于三项开放标签的单臂临床试验数据,FDA加速批准larotrectinib (商品名Vitrakvi®)用于治疗无已知耐药突变的、广泛转移或局部手术治疗效果不好的、现有治疗方案进展或无可替代治疗方案的,NTRK基因融合的成人和儿童实体瘤患者。
有望成为新型重磅药
Vitrakvi®是FDA首个批准的针对这种基因改变的且与“与肿瘤类型无关” (Tissue agnostic)的抗肿瘤化学药物。2017年5月,FDA曾批准Keytruda®用于治疗带有MSI-H (微卫星不稳定性高)的癌症患者,开创了“tissue-agnostic”疗法的先河。
FDA此前先后给予larotrectinib优先审评、突破疗法和孤儿药的资格认定。
目前研究发现,NTRK融合导致的致癌信号存在于<1%的实体瘤中,据预测,Vitrakvi®年销售额将达到5亿美元至10亿美元,有望成为按照分子路径进行疾病治疗的新型重磅炸弹。
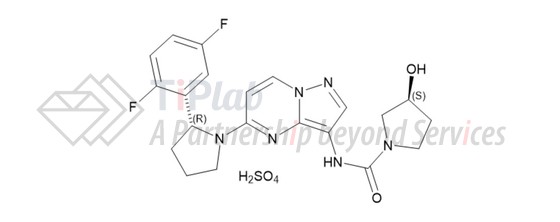
Vitrakvi®活性成分
Vitrakvi®(larotrectinib)胶囊和口服液均为larotrectinib硫酸盐配制而成。Larotrectinib硫酸盐的分子式为C21H24F2N6O6S,分子量为526.51 g/mol。Larotrectinib sulfate具有以下化学结构:
Vitrakvi®制剂
FDA批准的Vitrakvi®制剂包含胶囊和口服溶液。
每粒胶囊含25 mg或100 mg的larotrectinib (分别为30.7 mg和123 mg larotrectinib sulfate)。
口服液含有20 mg/mL的larotrectinib (24.6 mg/mL larotrectinib sulfate),辅料包含:纯净水、羟丙纤维素β-环糊精、蔗糖、甘油、山梨糖醇、柠檬酸、磷酸钠、柠檬酸钠二水合物和丙二醇等。
围绕Larotrectinib的专利申请
Larotrectinib最初是由Array Biopharma研发而成。2013年7月,Array与Loxo达成了合作,将其开发的一些化合物独家许可给Loxo,这其中包括:LOXO-101 (即larotrectinib)、LOXO-292 (一种RET抑制剂)和LOXO-195 (一种TRK抑制剂)。
活性成分专利家族
自2009年起,Array递交了涉及larotrectinib活性成分的PCT专利家族 (PCT/US2009/061519),PCT/US2009/061519进入了包括US、EP、JP、CN等多个国家或地域。
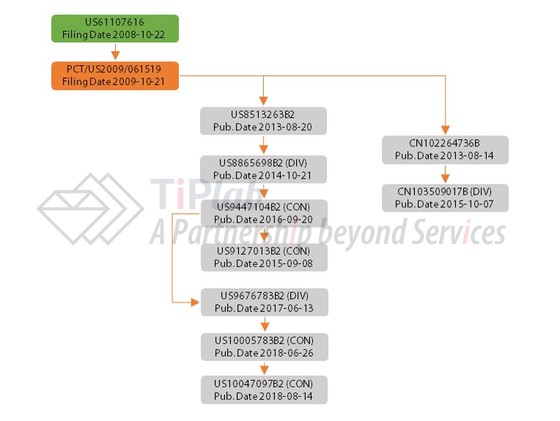
PCT/US2009/061519进入美国国家阶段的授权专利为US8513263B2,权利要求1涉及一种通式化合物,并限定了多个取代基,保护范围涵盖larotrectinib。加上63天的专利权调整,US8513263B2专利保护期将至2029年12月。
以US8513263B2为母案,Array递交了多个延续案或分案申请,涉及活性成分或治疗用途,比如:
US8865698B2涉及使用相关化合物治疗哺乳动物疼痛、癌症、炎症、神经变性疾病或Typanosoma cruzi感染的方法。
US9447104B2涉及减轻或改善哺乳动物癌症症状的方法,所述方法包括:首先确定癌症是否表现出Trk激酶的过表达、活化、扩增和突变中的一种或多种;如果确定癌症表现出Trk激酶的过表达、活化、扩增和突变中的一种或多种,给予哺乳动物治疗有效量的相关化合物。US9447104B2通过检测生物标志物对相关化合物的施用方法进行了限定。
US9127013B2涉及一种通式化合物,限定范围不同于母案US8513263B2。
US9676783B2涉及使用相关化合物减轻或改善一种或多种癌症症状的方法。
US10005783B2的8项独立权利要求分别涉及减轻或改善受试者神经母细胞瘤、神经胶质瘤、甲状腺癌和乳腺癌的一种或多种症状的方法。
US10047097B2涉及减轻或改善哺乳动物一种或多种肿瘤症状的方法,包括:检测肿瘤是否表现出Trk激酶的过表达、活化、扩增和突变中的一种或多种;向哺乳动物施用治疗有效量的larotrectinib或其药学上可接受的盐类或溶剂化物;进行手术至少部分切除肿瘤。
上述专利都列在larotrectinib的橙皮书专利列表中,保护期限都将于2029年底到期。
进入中国国家阶段授权专利CN102264736B及其分案CN103509017B均涉及一种通式化合物。
可见,Array的活性成分家族不仅涉及涵盖其产品的通式化合物,还从多种适应症、结合生物标志物检测的药物施用方法、不同程度的保护范围等多个维度对活性成分的治疗用途进行保护。
当然,可以预见的是,活性成分专利家族中专利们都将于未来的同一个时间段到期,仅仅这一个专利家族对产品的保护力度比较有限。
Array在其研发过程中,随着临床试验的开展和制剂配方的日渐成熟,也不断申请了新的专利家族以保护其即将上市的产品。
化合物晶型专利家族
Array于2015年递交了涉及化合物晶型的PCT国际申请 (PCT/US2015/060953)。
PCT/US2015/060953通过旁路途径 (Bypass)进入美国国家阶段已经获得了授权 (US9782414B2),涉及使用相关化合物治疗儿科患者癌症的方法,即对特定的患者人群进行了保护。之后FDA批准的larotrectinib的患者人群刚好也包括了儿童患者。
US9782414B2衍生的另外两个延续申请仍处于审查阶段,涉及晶型或其治疗用途。
PCT/US2015/060953进入中国国家阶段的专利申请仍处于审查阶段 (CN107428760A),涉及化合物的晶型。
制剂专利家族
Loxo获得了larotrectinib的独占许可之后,对larotrectinib的制剂配方进行研发并递交了PCT/US2017/025939专利家族。
PCT/US2017/025939专利家族通过旁路途径 (Bypass)进入美国国家阶段的授权专利US10137127B2涉及larotrectinib的液体制剂,限定了辅料包括β-环糊精和碱性物质,化合物或其药学可接受的盐的浓度为15 mg/mL~35 mg/mL。涵盖说明书中larotrectinib口服制剂的配方。
此外,Loxo于2017年还递交了PCT/US2017/025932专利家族,涉及使用larotrectinib或其药学可接受的盐治疗小儿癌症的方法,说明Loxo将会比较重视larotrectinib在儿科患者人群中的市场前景。
“Tissue-agnostic”型药物将成为趋势
Larotrectinib和pembrolizumab的获批证实了“tissue-agnostic”疗法的可行性,目前其它一些“tissue-agnostic”型候选产品也正处于开发阶段。比如,Ignyta和Roche合作开发的entrectinib正处于治疗NTRK融合阳性实体瘤患者的二期临床试验阶段,也是larotrectinib的潜在竞争对手。
“Tissue-agnostic”型药物的发展也预示着将会有更多患者受益于使用生物标志物指导疾病治疗或临床试验,当然基因或分子通路远比人们想象的复杂,也为此类药物带来了一些质疑。
不过毋庸置疑的是,疾病治疗将会朝着更加精准的方向发展,这对于时下热门的癌症免疫疗法 (Immuno-oncology drug)来说亦是如此,未来的挑战则在于开发更为可靠的生物标志物以实现更有针对性和更有效的疾病治疗。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
