明日之星Dupilumab
2017年3月28日,Sanofi和Regeneron开发的Dupixent®注射液(活性成分为dupilumab)获得FDA批准上市,用于局部治疗成人难治性中重度特应性皮炎(一种常见的湿疹),成为FDA批准的首个IL-4Rα抗体药物和首个用于治疗中重度特应性皮炎的生物制品。
2016年12月14日,美国FDA刚刚批准辉瑞的小分子特应性皮炎药物Eucrisa®(crisaborole,非甾体PDE4抑制剂),该药是15年来FDA批准的第一个治疗特应性皮炎的新分子实体,销售峰值预测可达20亿美元。2016年9月26日,Dupilumab获得FDA的优先审评资格,其也曾在2014年11月20日获得FDA的突破性疗法认证。作为首个被FDA批准用于治疗特应性皮炎的生物制品,Dupilumab的销售额预期可达到41亿美元(2022年)。
Dupilumab是全人单克隆抗体,其针对IL-4Rα上同时结合IL-4及IL-13的亚基,因此能够同时阻断IL-4及IL-13的信号传导。IL-4和IL-13对于引发和维持Th2免疫应答而言,是起关键作用的细胞因子,因此,人们认为这些信号传导通路在过敏性炎症的治疗中有至关重要的作用。
老对手的新对垒
Amgen与Sanofi和Regeneron之间围绕PCSK9抗体的专利战还未停息,二者就Dupilumab的专利问题又开始了新的斗争,真可谓“旧恨未解,又添新仇”。
上一次,Sanofi和Regeneron的产品一上市,Amgen就发起了专利侵权诉讼。这一次,Sanofi和Regeneron先下手为强,于3月20日在波士顿的地方法院发起了确认不侵犯专利权之诉。Sanofi和Regeneron认为,他们的产品Dupixent® (dupilumab)没有侵犯Amgen的第8,679,487号美国专利(‘487专利),并且希望得到法院的支持。
早在2000年左右,Amgen就开始研发治疗哮喘的单克隆抗体药物,他们制备的单克隆抗体能够作为拮抗剂来抑制IL-4和IL-13的信号传导活性,并被命名为AMG-317。然而,AMG-317用于治疗中度至重度哮喘的临床试验在2期宣布失败,Amgen继而放弃了对AMG-317的继续开发。药物研发之路常常吉凶未卜,但是Amgen仍然持有若干相关专利,这里面就包括’487专利。’487专利于2014年3月25日获得授权,权利人为Immunex(Amgen于2002年7月16日收购了Immunex,并且获得了其所有专利资产,包括 ’487专利)。
一朝被蛇咬,十年怕草绳。由于Amgen在专利维权方面一贯的强硬态度(犹记PCSK9抗体的永久禁令带来的痛),Sanofi和Regeneron对其可能采取的法律行动非常警惕。Sanofi和Regeneron的律师了解到,Amgen已经雇佣了诉讼律师准备就IL-4R抗体相关专利提出侵权诉讼,并且在积极寻找专家证人。鉴于Dupixent®是唯一将上市销售的IL-4R抑制剂,Sanofi和Regeneron认为Amgen和Immunex正在紧锣密鼓地筹划将他们告上法庭,使他们无法如期在美国销售Dupixent®。
Sanofi和Regeneron进一步认为,Dupixent®没有侵犯’487专利。为了做出判断,我们先来近距离了解一下’487专利。’487专利的最早申请日是2001年5月1日,加上336天的PTA专利期调整,到期日应该是2022年4月2日。授权的权利要求一共有17项,其中权利要求1请求保护:**“An isolated human antibody that competes with a reference antibody for binding to human IL-4 interleukin-4 (IL-4) receptor**, wherein the light chain of said reference antibody comprises the amino acid sequence of SEQ ID NO:10 and the heavy chain of said reference antibody comprises the amino acid sequence of SEQ ID NO:12”。结合说明书的内容可知,“参考抗体(reference antibody)”重链可变区的氨基酸序列如SEQ ID NO:12所示,而其轻链可变区的氨基酸序列如SEQ ID NO:10所示。
可见,权利要求1中通过结构特征部分限定了参考抗体,而要求保护的是能够与参考抗体竞争结合IL-4R的所有分离的人抗体。换言之,’487专利的权利要求1并没有直接对要求保护的抗体的结构进行限定,而是限定了其功能(即,competes with a reference antibody for binding to human interleukin-4 (IL-4) receptor)。Sanofi和Regeneron认为,由于’487专利的权利要求仅通过“功能性限定”描述了要求保护的产品(抗体),所以应该按照35 U.S.C. § 112 ¶ 6的要求对权利要求的保护范围进行解读(即,理解为means-plus-function类型的权利要求),相应地,Sanofi和Regeneron主张’487专利的权利要求1仅涵盖说明书中描述的能够实现所述功能(即competes with a reference antibody for binding to human interleukin-4 (IL-4) receptor)的那些具体抗体结构(单克隆抗体6-2、12B5、27A1、5A1、63或1B7)或它们的等同实施方式。由于Dupilumab的结构与这些具体的单克隆抗体都不相同,所以Dupixent®没有侵犯’487专利。
接下来,我们就要看法院是否会认同Sanofi和Regeneron主张的这种非常窄的权利要求解释方式,如果法院不认同并且按照’487专利权利要求的字面描述进行较宽泛的解释,则Sanofi和Regeneron的不侵权主张就不能成立。
Sanofi和Regeneron采取的行动不止于此,他们还于3月23日向美国专利商标局提交了双方复审请求(IPR No.2017-01129),请求宣告‘487专利中所有的权利要求全部无效。主要的理由是认为’487专利的优先权要求不成立,并基于现有技术公开的内容,认为’487专利请求保护的技术方案已被现有技术公开。
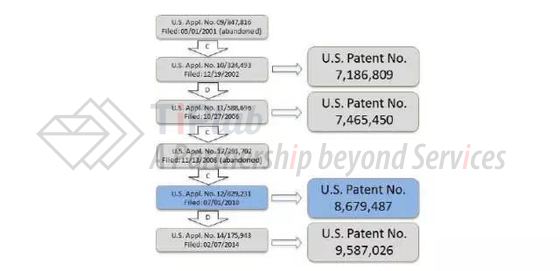
图1中显示了’487专利的家族历史。可以看到,’487专利是由’231专利申请授权得到的,而’231申请是这个家族中的第五代(申请日为2010年7月1日),其通过一系列继续申请和分案申请而享有最早母案(’816申请)的权益(如上文所述,最早母案的申请日为2001年5月1日)。Sanofi和Regeneron认为,’816申请没有充分描述、而且并未使得本领域技术人员能够实施’487专利要求保护的技术方案,相应地,’487专利不能享有2001年5月1日的优先权,而只能按照其实际申请日(即2010年7月1日)对现有技术进行划界。Sanofi和Regeneron提交了一篇2008年公开的美国专利申请U.S. Patent Publication No. 2008和0160035(申请人为Regeneron),认为其已经公开了’487专利请求保护的技术方案。所以,此案后续的进展取决于专利审判及上诉委员会(PTAB)对于优先权是否成立的判断。
专利布局的较量:Amgen vs. Sanofi和Regeneron
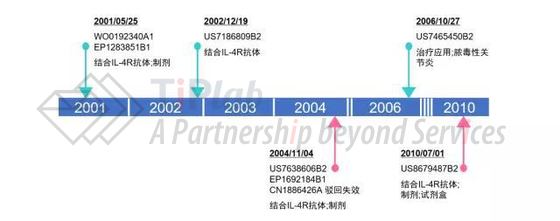
我们分析了Amgen围绕IL-4R抗体进行的专利布局,我们发现,从2001年至今,Amgen(Immunex)共递交了超过60件涉及IL-4R拮抗剂的专利(申请),其中部分代表性申请显示在图2中,主要涉及结合IL-4R的抗体、相关试剂盒、制剂以及这些抗体的医药用途,较晚递交的申请一经授权,其20年有效期将至2030年。
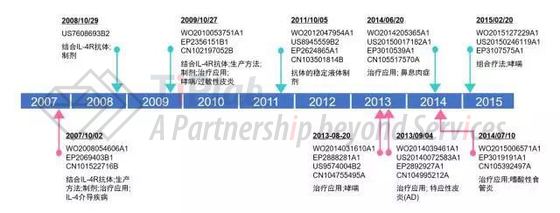
我们还分析了Sanofi和Regeneron围绕Dupilumab进行的专利布局,并发现Sanofi和Regeneron递交了近100件相关专利(申请),其中部分代表性申请显示在图3中。这些专利(申请)主要涉及结合IL-4R的抗体、其生产方法、抗体的稳定化制剂、针对各种适应症的医药用途及与其它活性成分联用的组合疗法。最近递交的申请一经授权,其20年有效期将至少到2035年。此外,我们还发现,Sanofi和Regeneron非常重视中国市场,其基本上所有的重要专利(申请)都进入了中国。
Amgen的’487专利如果被维持有效,鉴于Amgen在专利维权方面一贯的强硬立场,无疑将对后续希望研发IL-4R抗体的企业带来巨大障碍。如果Sanofi和Regeneron成功将Amgen的’487专利无效,则其基于自身强大的专利布局,也将具有极大的竞争优势。究竟鹿死谁手,让我们拭目以待。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
