阿斯利康与第一三共合作开发抗HER2 ADC药物
2019年3月,阿斯利康宣布与第一三共 (Daiichi Sankyo)达成合作协议,将共同负责ADC药物trastuzumab deruxtecan (DS-8201)作为单药或联合疗法,在日本以外地区的开发和商业化进程 (第一三共保留日本的权益)。为此,阿斯利康将向第一三共支付总计69亿美元的费用,包括13.5亿美元的预付款和高达55.5亿美元里程碑付款。
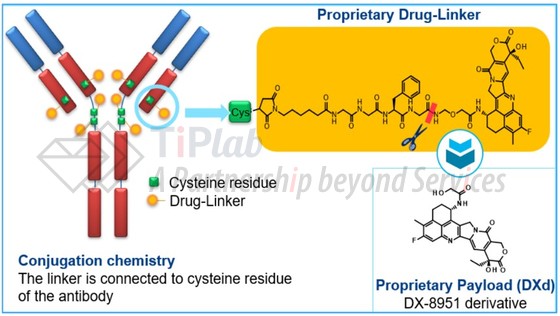
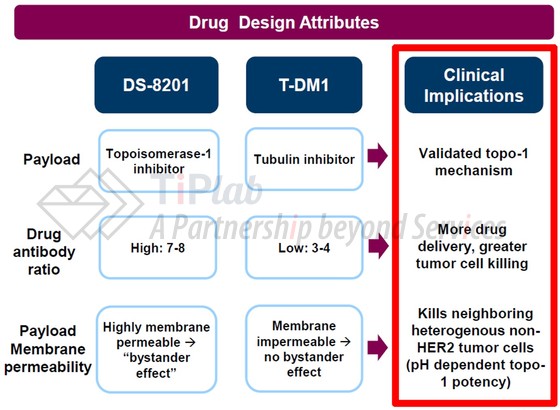
Trastuzumab deruxtecan最初由第一三共开发,是一种新型抗体-药物偶联物 (antibody drug conjugate,ADC),由人源化抗HER2抗体trastuzumab (赫赛汀®)、可切割的肽基连接体和拓扑异构酶I抑制剂组成,药物与抗体比率 (DAR)高达7~8。
HER2在多种癌症中都有表达,罗氏已经获批的HER2靶向疗法比如:trastuzumab、pertuzumab和ado-trastuzumab emtansine (T-DM1,Kadcyla®)在HER2阳性的肿瘤治疗中应用广泛,不过,HER2阳性患者在赫赛汀治疗后通常会产生耐药,目前也没有针对这些疗法治疗后进展的标准疗法获批,因此存在巨大的市场需求,而DS-8201可能成为治疗HER2阳性乳腺癌和胃癌的变革性新药。
此前,第一三共宣布将在2019年上半年加速DS-8201治疗先前接受过T-DM1治疗的HER2阳性转移性乳腺癌的上市进程,并计划于2019年下半年递交第一份BLA上市申请,该申请基于一项DESTINY-Breast01的临床2期研究。
DS-8201分别与T-DM1和自选疗法比较治疗HER2阳性转移性乳腺癌的3期临床研究 (DESTINY-Breast03和DESTINY-Breast02)也正在进行中。
第一三共将DS-8201的临床研究扩展至HER2低表达乳腺癌 (3期,DESTINY-Breast04),有望成为HER2低表达乳腺癌的首个疗法。
第一三共还在探索DS-8201在其它HER2阳性癌症中的应用,包括非小细胞肺癌 (NSCLC,2期)、胃癌 (DESTINY-Gastric01,2期)和结直肠癌 (2期),以及联合用药用途,比如与BMS的PD-1抑制剂Opdivo® (nivolumab)联合用于HER2表达的乳腺癌和膀胱癌 (1期)。
在美国,DS-8201获得了FDA授予突破性疗法,用于治疗HER2阳性、局部晚期或转移性乳腺癌患者,这些患者已经接受过trastuzumab和pertuzumab治疗,并且在T-DM1治疗后仍出现疾病进展,目前还未出现已获批的针对该适应症的药物。DS-8201还获得FDA授予的快速通道指定,用于治疗HER2阳性的不可切除和转移性乳腺癌,这些患者在接受过包括T-DM1的HER2靶向疗法后仍出现疾病进展。
在日本,DS-8201治疗HER2阳性晚期胃癌或胃食管连接部癌获得了日本厚生劳动省颁发的SAKIGAKE认定,相当于美国FDA的突破性疗法认定。
DS-8201的独特设计
不同于T-DM1使用的微管蛋白抑制剂DM1作为化疗药,第一三共开发了新型的拓扑异构酶I抑制剂喜树碱衍生物 (DX-8951衍生物DXd),通过一种四肽 (GGFG)linker与抗体缀合构建ADC。
另外,第一三共开发独特的linker-payload系统降低了ADC的疏水性,因此,DS-8201的每个抗体可以携带7~8个DXd分子,高于T-DM1 (3.5)。
当抗体结合HER2并内化后,DS-8201的四肽Linker可以被肿瘤细胞中高表达的溶酶体酶降解,从而释放DXd,DXd结合并抑制Top1-DNA复合物,从而抑制DNA复制、细胞周期抑制和肿瘤细胞凋亡。此外,DXd具有较高的膜穿透性,因此释放后的DXd可以穿透至邻近细胞,导致bystander杀伤效应。
围绕linker-payload系统的专利家族
自2013年10月起,第一三共首先递交了两个涉及ADC结构式的PCT申请 (WO2014057687A1和WO2014061277A1),这些专利家族保护范围较为宽泛,仅限定了linker-payload的结构式,涵盖所有与该限定的linker-payload连接的抗体缀合物。
WO2014057687A1进入美国、欧洲、日本和中国的专利申请均已获得授权,并有多个分案也获得了授权。中国授权专利ZL201380053256.2的权利要求1保护一种抗体-药物偶联物,包含抗肿瘤化合物 (即为DXd) 与抗体经由特定结构的linker连接而成,限定了linker的多种类型。
WO2014061277A1进入美国国家阶段的授权专利公告号为US9872924B2,其权利要求1涉及一种ADC,包含抗肿瘤化合物,即为DXd,化合物通过一种linker与抗体缀合,限定了linker的结构通式和多种取代基。
围绕DS-8201的专利申请
涉及抗HER2 ADC的专利家族
2015年,第一三共接着递交了涉及抗HER2 抗体ADC活性成分的PCT专利申请 (PCT/JP2015/000355)。
PCT/JP2015/000355以bypass途径进入了美国国家阶段,授权公告号为US10155821B2,其权利要求1保护一种抗体-药物缀合物,限定抗体为抗HER2抗体,并限定了linker和药物的结构式,涵盖trastuzumab deruxtecan活性成分。US10155821B2的分案申请US20190077880A1仍处于审查阶段,涉及使用ADC治疗癌症的用途,并限定了ADC的结构。
PCT/JP2015/000355进入中国国家阶段的申请仍处于审查阶段 (CN105829346A),CN105829346A的权利要求1涉及一种抗HER2抗体-药物偶联物,限定了药物的结构式和linker的结构通式。
PCT/JP2015/000355进入日本国家阶段的授权专利 (JP5998289B2)的权利要求1也限定了具体的linker结构式。第一三共还递交了多个JP5998289B2的分案申请,部分已经获得授权,比如:JP6046301B1、JP6466895B2和JP6105183B1分别涉及不同的linker结构。
目前,trastuzumab deruxtecan还处于临床研究阶段,可以预见PCT/JP2015/000355专利家族中的在审专利申请将会陆续获得授权,并且将会出现更多涉及活性成分或其不同治疗用途的分案申请。
其它专利家族
涉及生产工艺
2016年6月递交的WO2017002776A1涉及ADC的生产工艺,发明点在于特定的反应步骤和反应条件。WO2017002776A1在多个国家阶段的专利申请仍处于审查阶段。
涉及联用组合物
之前我们提到DS-8201与BMS的PD-1抑制剂nivolumab联用治疗HER2表达的乳腺癌和膀胱癌的1期临床研究正在进行中。
而早在2017年12月,第一三共已经着手递交相关专利家族 (WO2018110515A1),涉及包含ADC和免疫检查点抑制剂的药物组合物,限定ADC的linker-payload结构式与DS-8201的linker-payload相同。
涉及制剂
2018年8月,第一三共还递交了ADC制剂的专利家族WO2019039483A1,涉及包含ADC、组氨酸缓冲剂、蔗糖/海藻糖和表面活性剂的制剂配方,限定ADC的linker-payload结构式与DS-8201的linker-payload相同。
ADC药物的创新难点
ADC的治疗优势在于能够利用抗体的靶向性和payload的杀伤能力,ADC包含三个要素,需要精心设计才能获得理想的候选物,目前已获批上市的ADC药物屈指可数,可见其开发难度之大。
ADC的开发难点主要在于:抗原选择:理想抗原为内化抗原,并且具有肿瘤特异性和高表达量,以降低ADC对正常组织的毒性;linker的设计和优化:理想的linker应当在递送至靶细胞时发生裂解以及payload的选择和抗体选择优化等。
第一三共的linker-payload系统具有独特的设计优势,而围绕linker-payload系统的庞大专利家族也可见其创新高度。
目前临床数据显示DS-8201对于已接受过HER2靶向疗法的患者具有不错的疗效,相信未来DS-8201的应用潜力将会十分可观。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
