2017年8月18日对华海药业(Prinston)来说是个特别的日子,其向美国FDA递交的帕罗西汀胶囊简化新药申请(ANDA)历时3年,终于获得了批准。虽然帕罗西汀胶囊不是重磅药,其原研药Brisdelle自2013年上市至今,年销售额也不过几千万美元,但是这次获批,对于华海药业、乃至对于整个中国制药行业而言,都是一个里程碑。为什么这么说呢?因为这是罕见的、中国制药企业通过成功挑战专利而在美国获批的首仿药。在华海药业披荆斩棘的这三年中,收获的各种经验和教训都值得后来者借鉴。 
抢“第一”,险胜一步
华海药业这次通过ANDA获批的帕罗西汀胶囊,简单来说就是与原研产品Brisdelle基本上一模一样的”拷贝“型仿制药。这个药的活性成分为甲磺酸帕罗西汀,原研厂家为美国Noven公司(2016年,该药的所有相关权益转让给了Sebela,为了简明,本文中统称为Noven一方),这是目前唯一经FDA批准上市的用于治疗更年期妇女“热潮红”的非激素用药。可见,虽然这个药并不重磅,但也算是个细分治疗领域中“小而美”的品种,值得一仿。 
那么“首仿”是什么意思,又有什么好处呢?顾名思义,“首仿”就是第一个仿制药。一般而言,大家所抢的“首仿”,含义又更窄一些,通常指第一个递交、并在专利挑战中杀出一条血路,最终获批的仿制药。当这个“第一名”有什么好处呢?最大的好处就是可以获得180天的“首仿独占期”,在这期间,FDA不会批准其它仿制药申请。于是,在这宝贵的180天中,市场上通常仅有原研药和“首仿药”,首仿药相对于原研药有明显的价格优势,又不必与其它仿制药竞争,能够率先占领仿制药市场,因而大家都对首仿资格趋之若鹜。
可见,为了获得这180天的首仿独占期优势,首先拼的是“速度”。换言之,华海药业需要领先竞争对手一步把ANDA申请递交上去。同期仿制Brisdelle的厂家有两个,一个是华海药业,另一个是著名的仿制药企业Actavis。华海药业的ANDA申请是2014年4月7日交到FDA的,而三天后,即2014年4月10日,FDA收到了Actavis的ANDA申请。在“争第一”的这条路上,华海险胜,可以说占了先机。
专利挑战之路
然而,要想获得这180天的首仿独占期,除了需要抢第一,还得在专利挑战中杀出一条血路。事实上,这个首仿独占期正是对仿制药企业在专利到期前勇于进行挑战的行为给予的奖励。那么,如何进行专利挑战呢?根据规定,ANDA申请人需要针对橙皮书中所列的专利递交第IV段声明,认定相关专利无效或者自己的仿制药未侵犯这些专利权。可见,在评估专利挑战项目时,首先要针对橙皮书中的每个相关专利,判断其权利的稳定性以及一旦挑战该专利失败可能面临的风险。
在华海药业的ANDA中,对当时橙皮书中所列的所有专利都提出了第IV段声明,即认为这些专利均无效和/或未侵犯这些专利权。后来的诉讼中涉及到的专利如下表所示。 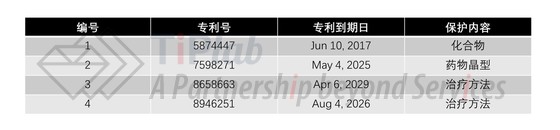
可以看到,其中化合物专利’447最早到期,而另外三个专利(’271, ’663,和’251)均要到十几年后才到期。进一步研究过这个表中的专利后,Dr.Zhang认为,本案的局面对华海药业进行专利挑战来说是比较有利的。
首先,作为一模一样的仿制药,华海药业的产品基本上必然会侵犯化合物专利,而将其全部无效的难度又相对较大,也就是说,挑战该化合物专利胜算并不大。但是,即使失败,对于仿制药最终“按时”上市的影响也不是太大。为什么这么说呢?第一,原研药Brisdelle最初上市时获得了三年的新产品(NP)市场独占保护,这个独占期2016年6月28日才到期。也就是说,不管专利挑战的结果怎样,FDA在2016年6月28日之前无论如何不能批准任何Brisdelle的“拷贝型”仿制药。这离该化合物专利的最终到期日2017年6月10日相差不到一年。第二,通常,原研药公司在收到仿制药企业提交ANDA的告知函和提出专利挑战的“战书”后,大部分将选择及时提起侵权诉讼,一旦诉讼开始,该ANDA申请的获批日期会自动延迟30个月。这么一算,等到这30个月的“延迟期”快过时,该化合物专利也差不多要到期了。所以,华海药业针对该化合物专利的挑战可以看做是放手一搏,如果成功想必会喜出望外,即使失败,其仿制药的上市日期也顶多推迟一年,结果并不算太差。本案的实际结果是,双方最终达成协议,华海药业同意其仿制药在2017年6月10日之前不上市销售,而Noven一方同意撤回基于’447专利的侵权诉讼。
但是,另外三个专利的到期日还远着呢,要是等到这三个专利都到期再上市,黄花菜都凉了。Dr. Zhang认为,对华海药业有利的地方在于,’271, ’663和’251专利都是“纸老虎”型专利,它们看起来保护期长,但是因为专利申请文件撰写中的缺陷,或者发明高度不高,都比较容易挑战成功。
咱们首先来看看保护药物晶型的’271专利。这个专利只有一个权利要求:
- “Crystalline paroxetine methanesulfonate having the following IR peaks: 531, 546, 777, 838, 931, 962, 1038, 1100, 1169, 1208, 1469, 1500, 1515, 1615, 2577, 2869, 2900, 3023”.
可见,其保护的是具有特定IR特征峰的一种甲磺酸帕罗西汀晶体。然而,这无疑是一个没有写好的药物晶型专利。事实上,用且仅用IR特征峰来表征晶型并不是一个明智的选择,因为其容易随各种因素而变化。即使是同一个化合物的同一种晶型,在不同条件下测得的IR谱也时常不同。本领域公认的更靠谱的表征手段是XRPD图谱。结果,华海药业的ANDA申请材料显示,虽然其仿制药的XRPD特征谱与原研药一致(提示二者晶型相同),但是测得的IR谱中缺少’271专利的权利要求1中所列的所有18个峰。也就是说,华海药业的仿制药并没有侵犯’271专利。尴尬的是,连原研药Brisdelle自己也可能不在’271专利唯一的权利要求的保护范围内。专利的保护范围由权利要求界定,而’271专利的权利要求既没有涵盖Noven一方自己的产品,也没有涵盖仿制药企业的产品,可谓是一个典型的“纸老虎”专利。
接下来,咱们再看看’663专利和’251专利。这两个专利都涉及用日剂量为7.5mg的帕罗西汀组分治疗与更年期相关的热调节障碍。华海药业向法院提供了现有技术证据,表明该发明的“高度”不高,相对于现有技术中已知的信息是“显而易见”的。仔细阅读这两个专利的说明书后还可以看出,其中基本上不包含证明发明效果的实验数据,因而地方法院还认为这两个专利“不具备可信实用性”并且缺乏“书面描述”。最终,地方法院认定’663专利和’251专利无效。
综合来看,华海药业面对的是1个较强但较早到期的化合物专利和三个较晚到期但均较弱的“外围”专利,这样的组合无疑为华海药业专利挑战的成功奠定了基础。Dr. Zhang认为,基于目前的证据和相关专利的情况,Noven一方即使选择上诉,二审扳回一城的可能性也并不大。在专利挑战方面,可以说华海药业已经取得了阶段性胜利。
溜走的首仿独占期
上文提到,对于仿制药企业而言,争得“第一”和“挑战专利”成功后,最大的奖励就是能够获得180天的市场独占期,从而抢先一步占领仿制药市场。华海药业以三天的优势险胜Actavis获得首仿资格,又在专利挑战中取得了阶段性胜利,是否能够坐享胜利果实了呢?很可惜,并不能,这180天独占期从华海药业的指缝中溜走了。
事实上,为了督促企业合理利用这180天的首仿独占期,FDA出台了若干限制性规定。在很多条件下,若不满足相关规定,首仿企业将丧失(forfeiture)历尽千辛万苦争取到的这180天独占期。很不幸,华海药业此次丧失了自己好不容易争取来的独占期。根据FD&C法案505(j)(5)(D)(i)(IV)的规定,首仿企业需要在ANDA递交后30个月内获得FDA的预批准(tentative approval),否则就会丧失原本有资格获得的180天首仿独占期。这项规定是为了防止企业仅仅出于“争第一”的目的,在申请材料准备不充分的情况下仓促提交ANDA,而鼓励企业提交高质量的申请材料。华海药业的ANDA是2014年4月7日递交的,30个月期满时仍未获得预批准,因而让首仿独占期溜走了。鉴于竞争对手Actavis的ANDA已于2017年6月20日获批,在丧失了首仿独占期的情况下,华海药业不得不与强劲的对手正面竞争。
从帕罗西汀胶囊的故事可以看出,中国企业若想通过专利挑战争得首仿,并保住180天独占期,一方面需要选择合适的品种,谨慎评估专利挑战的难度和风险,另一方面也需要尽可能充分地准备ANDA申请文件,以争取早日获批。当然,从获批到上市销售还有一段路要走,若不提前布局,也会导致丧失机会。我们希望,先驱者的经验和教训能给后来者以启发,也希望看到越来越多的中国药企活跃在世界的舞台上。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
