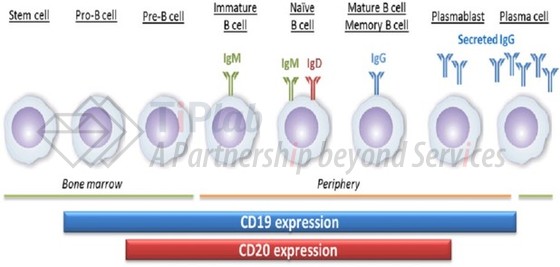
Inebilizumab消耗表达CD19的B细胞
2020年6月10日,FDA批准Viela Bio开发的Uplizna®(inebilizumab)静脉注射用于治疗AQP4-IgG血清反应阳性的成人患者NMOSD。Inebilizumab是第二种被批准治疗该疾病的药物,其中第一款为Alexion制药开发的Soliris®(eculizumab)。

NMOSD是一种罕见的中枢神经系统自身免疫性疾病,其中免疫系统细胞和自身抗体会攻击并损害视神经和脊髓。NMOSD主要与一类自身抗体—AQP4-IgG有关,该类抗体由B细胞分化的浆母细胞和浆细胞产生,其能结合广泛存在于中枢神经系统的星形胶质细胞,由此触发免疫细胞攻击。
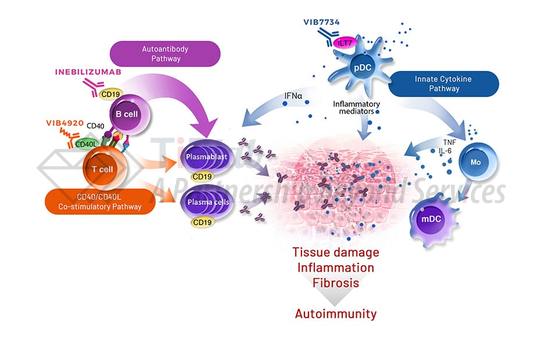
CD19广泛表达于B细胞表面和其分化形成的浆母细胞/浆细胞表面,较只表达在B细胞表面的CD20更广泛。Inebilizumab靶向CD19,利用Fc部分招募NK细胞和巨噬细胞,通过ADCC和ADCP消耗表达CD19的B细胞(包括浆母细胞和浆细胞),减少抗原呈递并减少促炎症因子。FDA曾授予inebilizumab治疗NMOSD的孤儿药称号和突破疗法。
围绕inebilizumab的核心专利资产
Inebilizumab研发起源于Duke大学,其后几经转手,包括Cellective Therapeutic,MedImmune Inc.,AstraZeneca和Viela Bio。涉及的专利资产集中在Duke和MedImmune Inc.,Viela Bio主要通过许可或转让获得相关专利资产。
Duke University创设的专利资产
Duke于2006年开始递交多个与anti-CD19抗体相关的活性成分和医药用途专利申请,其中医药用途涉及肿瘤、自身免疫疾病以及移植排斥等多个方面,目前有效的专利主要涉及治疗B细胞相关淋巴瘤的用途和anti-CD19抗体序列,还有部分专利申请已被驳回。
2006年2月,Duke在同一天递交了涉及anti-CD19抗体活性成分的专利申请PCT/US2006/005676和US11/355905,要求了以美国临时申请US60/653587和US60/702063为优先权,不过US11/355905因为新颖性问题被驳回。
之后,Duke于2010年9月递交了US11/355905的部分延续申请US12/885341,涉及B细胞紊乱医药用途,其授权公告号为US8444973B2。权利要求1保护利用经Fc区修饰后ADCC增强的anti-CD19抗体消耗表达CD19的B细胞,限定患者为B细胞相关的肿瘤患者,不涵盖inebilizumab的自身免疫病用途。

US11/355905另一个授权的延续案为US9260530B2,其权利要求1保护包含anti-CD19抗体的药物组合物,限定了抗体的序列特征和介导ADCC的功能,序列方面保护在SEQ ID NO:4和SEQ ID NO:18的一个或多个CDR序列基础上引入一个氨基酸突变,即保护了多组anti-CD19抗体的序列。

将SEQ ID NO:4和SEQ ID NO:18与inebilizumab的VH和VL序列比对发现,inebilizumab的VH为SEQ ID NO:4的51-68位氨基酸中第64位、101-114位氨基酸中第108位引入突变,VL为SEQ ID NO:18的74-80位氨基酸中第74位引入突变。也就是说该权利要求涵盖inebilizumab的序列,保护了inebilizumab。

US9260530B2保护了宽泛的anti-CD19抗体的药物组合物,包含多组不同的CDR序列且能够涵盖inebilizumab的序列。
MedImmune Inc.设立的专利资产
2005年MedImmune Inc.收购了Cellective Therapeutic,进而获得Duke的专利许可。2018年,Viela Bio从AstraZeneca生物制品研发子公司MedImmune中独立出来,获得MedImmune关于anti-CD19抗体产品及其专利资产的权利,且继续享有Duke关于anti-CD19抗体以及专利资产的独占许可权。
2007年9月,以美国临时申请US60/842935、US60/866917等为优先权,MedImmune在同一天递交了PCT/US2007/077916专利申请和美国专利申请US11/852106,授权公告号为US8323653B2。
US8323653B2最初公开的权利要求1要求保护anti-CD19抗体的VH和VL序列通式SEQ ID NO:237/238,其内含有多个任意氨基酸X。该权利要求旨在获得宽泛的活性成分专利保护,然而Duke在先申请的关于anti-CD19抗体的专利申请对其造成影响。

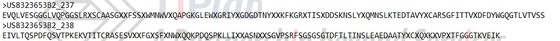
第一次审查意见中,审查员指出US2006/0233791(申请号:US11/355905)披露了鼠源anti-CD19抗体HB12B的VH和VL序列,该抗体具有权利要求1的VH和VL通式中衍生的CDRs,因此权利要求1中通式涵盖的具体CDR已经被公开。
同时US2006/0233791虽然没有披露本权利要求1中特定的人FRs的人源化抗体,但是其说明书披露了该抗体可以利用与亲本相近的人FR替换,来产生人源化anti-CD19抗体的方法,且通式中的人FR序列都是现有技术。

基于以上原因,MedImmune将权利要求1修改为限定具体VH/VL的氨基酸序列,即为inebilizumab的VH和VL序列,获得了一个较小范围的活性成分专利保护。

由此可以发现,当构建药品核心专利资产的过程中,特别是药品开发过程中涉及到多个不同的申请人,需注意其它申请人的在先申请是否可能会构成在后申请的现有技术或抵触申请,影响在后申请的新颖性和创造性,因此,需要把握好专利递交的时机以及申请文件的撰写方式,比如:在撰写申请文件前制定好申请策略(以更好解决新颖性和创造性问题),选择在先申请公开前递交在后申请等。
同族成员CN101534859B和US8883992B2分别保护SEQ ID NO:106和111编码的VH和VL序列以及编码该序列的核苷酸分子;US9896505B2为医药用途专利,权利要求1保护利用inebilizumab治疗B细胞疾病或紊乱,包括自身免疫疾病。
有趣的是,该家族还有一个以Viela Bio为申请人的2018年递交的专利申请US20180273621A1,其权利要求1继续请求保护anti-CD19抗体的VH和VL序列通式SEQ ID NO:237/238,这与上述讨论的US8323653B2最先要求保护的权利要求相似。可以看出,Viela Bio还在通过不断递交多个分案申请以扩大保护范围、延长保护时间。

Inebilizumab核心专利资产特点
涵盖inebilizumab的核心专利资产主要集中在Duke大学和MedImmune递交的两个专利家族,第一个家族比较宽泛,涵盖抗体的多组序列,第二个家族涉及上市产品,既能够阻止竞争者使用与inebilizumab相同的序列,也能够阻止竞争者在inebilizumab序列上做一些点突变以绕开专利障碍。
由于第二个专利家族递交时第一个专利家族已经公开,且保护的内容相似,这给在后申请能够争取到的保护范围造成了一定的影响,不过MedImmune最终也获得了保护上市产品的专利资产,并从一定程度上延长了产品的生命周期,若能够更好规划这两个家族的撰写策略,则可能可以争取一个更大的范围。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
