罕见病基因疗法AVXS-101获FDA优先审评
2018年12月,FDA接受了基因疗法AVXS-101 (onasemnogene abeparvovec,品牌名Zolgensma)治疗1型脊髓性肌萎缩症 (Spinal muscular atrophy,SMA)的BLA上市申请,并授予其优先审评资格,预计可能于2019年获批。
AVXS-101通过腺相关病毒载体 (AAV)将正常基因递送至患者体内,以治疗一种罕见遗传疾病—脊髓性肌萎缩症。
脊髓性肌萎缩症是一种神经肌肉疾病,其特征是运动神经元丧失并导致进行性肌肉无力和瘫痪。SMA是由编码SMN (Survival motor neuron)蛋白的SMN1基因缺陷引起的,SMN蛋白是运动神经元存活的必需蛋白质。SMA的发病率约为1/10000活产婴儿,是导致婴儿死亡的主要遗传原因。
根据疾病发作和严重程度,SMA分为四个子类别—SMA 1、2、3和4型,其通常与SMN蛋白的水平相关。
最严重的SMA形式是1型,90%以上的患者在两岁以前死亡或需要永久通气支持。
为此,AveXis开发了AVXS-101,使用AAV9载体将功能完整的人SMN1基因直接运送到细胞中来治疗脊髓性肌萎缩。
AveXis是一家基因治疗公司,致力于罕见神经遗传疾病新型疗法的开发和商业化。
AVXS-101的诞生史
AVXS-101利用重组AAV9病毒载体将人SMN1基因的功能性拷贝递送至患者细胞内,使其表达SMN蛋白来治疗疾病。
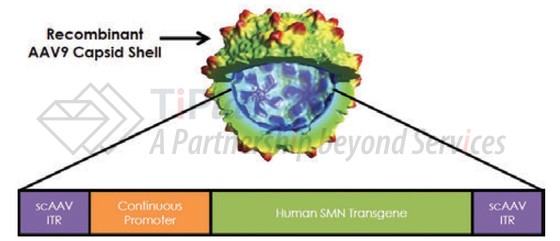
AVXS-101的开发基于两种重要的平台技术:重组AAV9病毒载体和自身互补DNA技术。
在AVXS-101出现之前,使用基因疗法治疗神经系统疾病通常需要在患者的头部钻孔,因为药物无法穿过血脑屏障并到达神经系统。
而AVXS-101使用的重组AAV9病毒载体可以穿过血脑屏障,到达中枢神经系统来治疗相关疾病。其研发过程也经历了一些曲折。
腺病毒载体的安全性问题
研究人员在初期使用的是腺病毒作为基因治疗载体,因其不会插入到宿主细胞基因组中而更为安全,为了开发腺病毒载体的治疗潜力,在得到了一些初步结论后,FDA批准了腺病毒的临床试验申请。
1999年,宾夕法尼亚大学 (UPenn)的遗传学家James Wilson主导了这项临床试验,以测试使用腺病毒载体进行基因治疗的安全性,不幸的是,一名18岁的小男孩Jesse Gelsinger却因注射腺病毒载体带来的强烈免疫反应而死亡。
Wilson因该事件面临诉讼和FDA的调查,不过,也正是这一事件使得Wilson将其研究方向转向了更为安全的腺相关病毒。
Wilson团队成功开发AAV9病毒载体
2004年,Wilson团队报道他们发现了100多种新型AAV,不同于其它类型的AAV,当以高剂量将AAV9注射至血液中时,AAV9可以归巢至神经元。
在发现了这一令人鼓舞的结果后,Wilson团队首先递交了两个US临时申请—US60/508226和US60/566546,从而在递交正式申请时可以享有优先权。在临时申请12个月的优先权期限内,他们递交了一个PCT国际申请—PCT/US2004/028817。
作为AAV9技术的基础专利,PCT/US2004/028817进入了美国、中国、欧洲、日本和加拿大等多个国家或地域,这些专利大都获得了授权。
比如,美国授权专利US7906111B2的权利要求1保护:
“A non-naturally occurring adeno-associated virus (AAV) comprising an AAV9 capsid wherein the AAV9 capsid comprises AAV9 capsid proteins with an amino acid sequence selected from the group consisting of: the amino acids (aa) 1 to 736 of SEQ ID NO:123; the aa 138 to 736 of SEQ ID NO: 123; and the aa 203 to 736 of SEQ ID NO: 123, said AAV further comprising a minigene having AAV inverted terminal repeats and a transgene comprising a heterologous gene operably linked to regulatory sequences which direct expression of the heterologous gene in a host cell.”
权利要求1涉及包含AAV9衣壳的AAV,并限定了AAV9衣壳蛋白的部分氨基酸序列。
申请人还递交了US7906111B2的多个延续申请,包括已获得授权的US9737618B2和处于在审阶段的US20170159027A1。
进入中国国家阶段的专利申请及其分案至少有四项都获得了授权,比如CN1856576B。
根据AveXis的披露,PCT/US2004/028817家族的部分专利 (申请)已经许可给ReGenX,并由ReGenX独家许可给了AveXis,PCT/US2004/028817家族的专利预计于2024年到期。
证实AAV9可以穿过血脑屏障
2009年,一个法国团队和Nationwide Children’s Hospital的Brian Kaspar实验室分别发现了给小鼠静脉注射AAV9,其可以穿过血脑屏障。
Brian Kaspar等人作为发明人于2009年递交了PCT国际申请PCT/US2009/068818,并要求临时申请US61/139470的优先权。之后申请人递交PCT申请的部分延续申请进入了美国国家阶段,不过目前状态是放弃。
PCT/US2009/068818专利家族同样许可给了AveXis。
AVXS-101临床试验获批
接着Nationwide团队选择针对SMA1基因—造成婴儿死亡的常见遗传原因,来验证AAV9作为载体在人体中的治疗效果。
但考虑到注射到血液中的AAV9只有不到1%的原始剂量可以穿过血脑屏障,因此Nationwide团队提出使用比先前基因治疗临床试验中高100倍剂量的给药方案。
经过了一番审查,FDA批准了该临床试验,Kaspar联合创立的AveXis获得了该临床试验的许可,负责AVXS-101的后期的临床研究。
幸运的是,他们取得了可喜的结果,虽然受试者在接受高剂量静脉注射后不久出现了肝酶飙升的症状,不过并没有出现肝损伤的临床症状。Wilson称这正是我们一直所期待的基因疗法。
患有SMA的Evelyn Villarreal在8周大的时候接受了AVXS-101的治疗,目前已经可以正常走路、跳舞和说话。
在一项START的临床试验中,输注AVXS-101的15名患者在24个月均保持生存状态,而且不需要永久通气。
基于优秀的临床试验结果,FDA已授予AVXS-101用于治疗所有类型的SMA孤儿药指定和突破性疗法指定,以及用于治疗SMA 1型的快速通道指定。
同时,AVXS-101在日本获得了SAKIGAKE资格认定,预计将在2019年上半年就其新药上市申请做出决定。在欧洲,AVXS-101获得了PRIME (Priority Medicines)资格认定,这些都相当于FDA的突破性疗法资格认定。
诺华大手笔收购AveXis
制药巨头诺华看中了AVXS-101的治疗潜力,于2018年4月宣布将以每股218美元,共计87亿美元收购基因治疗公司AveXis。5月份,诺华完成了对AveXis的收购,扩充了其在基因治疗领域的管线布局。
AVXS-101可能成为继诺华的CAR-T基因疗法Kymriah之后的第二款基因治疗产品。
AVXS-101作为基因治疗的优势在于一次性治疗以及简单的静脉给药方式,期待这一疗法的上市能受益遭受SMA罕见病的婴儿患者。
AveXis的专利策略
我们发现,类似AveXis的“独角兽”公司通常依托于高校或研究所的基础研究成果,因此,在早期主要通过外部许可的方式来构建专利壁垒,值得一提的是,有了平台技术之后,后期申请一些涉及不同候选产品以及改进技术的专利来补充其专利资产对于加强竞争优势尤为重要。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
