抗IL-13抗体药物lebrikizumab
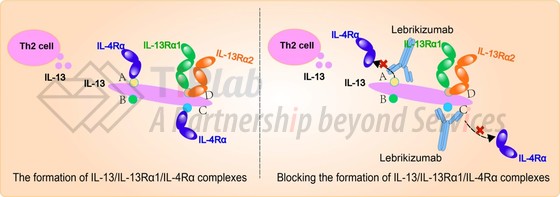
Lebrikizumab是人源化的抗白介素13(IL-13)的单克隆抗体。IL-13是一种天然存在的细胞因子,在介导炎症对身体组织的影响中起重要作用。Lebrikizumab能够以高亲和力结合IL-13,防止IL-13受体/IL-4受体复合物形成,阻断其信号传导。
Lebrikizumab最初由Tanox公司开发,名称为TNX-650;2007年Genentech收购Tanox,随后对lebrikizumab进行了肿瘤、炎症与哮喘方面的研究;2009年Roche完成了对Genentech的收购,但lebrikizumab在这段时间的临床研究表现并没有非常突出。
2017年,Dermira——一家专注于皮肤病药物开发的公司与Roche达成一项药物许可协议,Dermira以14亿美元的价格获得lebrikizumab用于特应性皮炎及其他适应症的全球独家开发和商业化权益,Roche保留该药物用于间质性肺疾病(例如特发性肺纤维化)治疗的全球开发权益。
终于,在2019年10月,lebrikizumab传来了好消息,Dermira公司公布结果显示lebrikizumab单药治疗成人患者中重度特应性皮炎的2b期剂量递增临床试验中获得积极效果:三个剂量都达到试验的主要终点,与安慰剂相比,lebrikizumab显著改善了患者的湿疹面积及严重度指数(EASI)。目前Dermira已经启动lebrikizumab的3期临床研究。
围绕lebrikizumab的专利申请
活性成分专利家族
2004年12月23日,Tanox以美国临时申请US60/532,130为优先权,递交了涉及抗IL-13抗体的PCT专利申请——PCT/US2004/043501。
PCT/US2004/043501进入中国的授权专利为CN1973053B,权利要求1涉及一种与人IL-13特异性结合的抗IL-13抗体,限定了抗IL-13抗体的结合表位。其授权范围比较宽泛,与ATCC编号为PTA-5657的杂交瘤产生的抗IL-13抗体结合IL-13表位相同的抗IL-13抗体均会落入其保护范围内,该专利能够有力地阻止其竞争对手关于抗IL-13抗体的生产经营活动,且较难规避。该专利预计将于2024年12月到期。

在CN1973053B的基础上,Tanox递交了多个分案申请,其中:
分案CN102993302B限定一种抗IL-13抗体,其竞争性抑制由ATCC编号PTA-5657的杂交瘤生产的抗体与IL-13的结合,范围同样比较宽泛。

PCT/US2004/043501进入美国的授权专利为US8067199B2,在两个独立权利要求中分别限定了重链和轻链序列,权利要求1涉及一种编码抗人IL-13抗体重链或重链可变区的核苷酸序列,权利要求2涉及一种编码抗人IL-13抗体轻链或轻链可变区的核苷酸序列,其中限定抗体的重链和轻链可变区包含由ATCC登记号PTA-5657指定的杂交瘤产生的抗IL-13抗体的CDR。

在US8067199B2的基础上,Genentech递交了多个分案或延续申请,其中:
“US8088618B2限定了抗IL-13抗体的重链和轻链CDR序列;
US8088618B2的延续案US9067994B2限定抗IL-13抗体与由ATCC编号PTA-5657的杂交瘤生产的抗体结合IL-13的表位相同。”
目前,还有一个延续申请US20180251538A1处于在审状态,其限定抗IL-13抗体与IL-13结合表位的序列,说明这个专利家族目前还处于活跃的状态,日后其圈定的权利要求范围可能还会逐步变大。
可见,lebrikizumab的活性成分专利保护做得十分严密,除了获得了限定抗IL-13抗体结合表位的保护范围之外,还另外获得了限定抗体具体重链和轻链CDR的专利,加强其核心专利家族的稳定性。
医药用途专利家族
Lebrikizumab的适应症开发过程并不顺利,不过伴随其研发过程的进展,Genentech针对其开发过的不同适应症均递交了专利申请。
治疗癌症
Tanox本来认为lebrikizumab会在肿瘤治疗方面大展身手,于是早在2004年12月,Tanox在递交活性成分专利家族的同时,以相同的美国临时申请US60/532,130为优先权,递交了涉及抗IL-13抗体用于治疗肿瘤的PCT专利申请——PCT/US2004/043541。
PCT/US2004/043541进入美国的授权专利号US7674459B2,其权利要求1保护一种治疗癌症的方法,包括对有需要的患者施用有效量的特异性结合人IL-13的抗IL-13抗体或其抗原结合片段,其中所述抗体或抗原结合片段与具有ATCC登录号PTA-5657的杂交瘤228B/C-1产生的抗体竞争。在权利要求1中,对抗IL-13抗体的限定较为宽泛。

随后,Tanox便启动了TNX-650治疗难治性霍奇金淋巴瘤的安全性和有效性的1期与2期研究,不过发现其癌症的治疗上效果不是很好。
治疗哮喘
2007年在Genentech收购Tanox之后,将lebrikizumab的研究转移到了其它方向,2009年7月Genentech启动了lebrikizumab针对哮喘治疗的II期临床试验。
在获得了一些初步结果之后,2011年开始,Genentech在US8067199B2的基础上,陆续递交了涉及治疗哮喘的多个分案申请,包括已获得授权的US8734797B2。
2013年6月,Roche启动两项lebrikizumab治疗不同患者人群的哮喘的三期临床试验,但是之后研究表明这两个临床试验的结果不够理想。
治疗特应性皮炎
虽然之前lebrikizumab的临床表现不尽如人意,Genentech并没有放弃,而是继续探索lebrikizumab在特应性皮炎方面的治疗前景。
2013年,Genentech首先递交US8067199B2的一个分案申请,涉及一种用于在患者中治疗特应性皮炎的方法。 2015年7月,Roche启动了关于lebrikizumab治疗特应性皮炎(Atopic Dermatitis,AD)的探索性2期临床试验,结果表明lebrikizumab与外用药联合治疗AD,能显著提高疗效。 在获得这个激动人心的结果之后,Genentech和Roche于2017年9月,递交了另外的PCT专利申请(PCT/US2017/052891),用于保护其治疗特应性皮炎的用途。
PCT/US2017/052891进入美国的专利申请号US20190270803A1,其权利要求1涉及一种在患者中治疗特应性皮炎的方法,该方法包括向患者施用包含治疗有效量的IL-13拮抗剂的药物组合物。

随后,Roche与Dermira达成合作,Dermira于2018年1月启动了2b期临床试验,评估lebrikizumab作为单一疗法与安慰剂相比的安全性和有效性,获得了积极效果,结果表明lebrikizumab显著改善了患者的湿疹面积及严重度指数(EASI)。目前Dermira已经启动lebrikizumab的3期临床研究。
结语
根据对lebrikizumab相关专利的研究,我们得以一窥其研发进程。最初在Tanox手中其研发重点在于治疗肿瘤,而后Tanox被收购之后Genentech希望它能在治疗哮喘方面发挥,但其表现没有达到他们的预期,最终Dermira从Roche手中收购lebrikizumab的全球独家权益,这一次,lebrikizumab似乎没有让他们失望,具体结果如何,我们可以拭目以待。
对于曲折漫长的药物研发历程,专利如何布局?也许有人会说,似乎之前lebrikizumab申请的关于治疗肿瘤、炎症、哮喘的专利没有作用,但是我们不能忘记的是我们站在多年之后局外人的角度,而在当时当地,谁也无法完全有信心地得出这种结论。
药物研发的艰难,一部分也来自与时间的较量。相关的专利申请更像是一种“保险”的机制:从lebrikizumab来看,不管临床试验效果如何,及早地“占地为王”,通过较低的成本保护自己的权利,阻止他人特别是竞争对手进行类似的开发,也许有一天它便能焕发新生,这也只能交给时间了。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
