血友病领域首个双特异性抗体—Emicizumab
2017年11月,FDA批准emicizumab (商品名:Hemlibra®)用于存在VIII因子抑制物的A型血友病的成人和儿童患者的常规预防,以预防或减少出血的频率。
2018年10月,FDA又批准emicizumab用于不具有抑制物的A型血友病患者常规预防,通过每周 (或更低频率)皮下注射给药。
预计2025年,Hemlibra®的销售额将达到50亿美元。罗氏的三大重磅药这几年正面临专利到期,Hemlibra®的获批有望使其保持销售增长。
血友病领域的市场空间
血友病是一种先天性凝血功能障碍的出血性疾病,由凝血因子 VIII (A 型血友病)或凝血因子 IX (B 型血友病)缺乏所致。A型血友病比B型血友病更为常见,约占血友病患者总数的 80-85%,每5,000-10,000人中大约有1人受到A型血友病的影响。2018年5月,国家卫生健康委员会等5部门联合制定了《第一批罕见病目录》,血友病被收录其中 (约10万人)。
A型血友病通常使用VIII因子替代疗法 (包括血浆和重组来源)进行治疗,采用日常预防性治疗和按需治疗相结合的方式,日常预防性治疗可改善患者生活质量,而国内一般采用按需治疗方式,未来存在一定的市场空间。
在emicizumab获批前的产品都是VIII因子类产品,不过,VIII因子替代疗法存在一些局限性,比如:需要每周静脉注射两次到三次,患者顺应性较差,尤其是对于儿童患者。此外,凝血因子替代疗法易出现严重的并发症—产生抑制物 (一种中和凝血因子的IgG抗体),对于伴有抑制物产生的患者还需要通过使用旁路制剂 (如重组因子VIIa)或免疫耐受疗法。因此,迫切需要新的A型血友病疗法来满足临床需求。
Emicizumab的诞生
Emicizumab是一种经修饰的人源化双特异性IgG4单抗,可以结合因子IXa和因子X,Emicizumab可以桥连激活因子IXa和因子X,从而恢复VIII因子的功能,由CHO细胞生产获得。Emicizumab与VIII因子没有序列同源性,因此不会诱导或增强FVIII抑制物的产生。
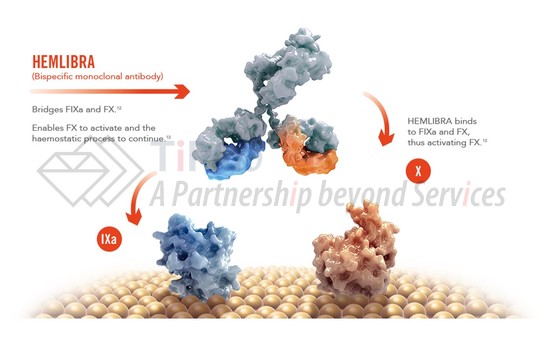
Emicizumab最初是由Chugai (2014年被罗氏收购)使用其抗体工程化技术开发而成,在获得FDA批准之前,emicizumab先后获得了治疗A型血友病 (具有VIII因子抑制物)的孤儿药认证和突破性疗法认证。基于两项3期临床试验的结果,2017年11月获得了FDA的批准,用于存在VIII因子抑制物的A型血友病的成人和儿童患者的常规预防。
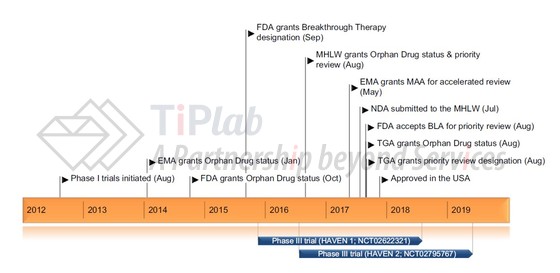
Emicizumab的获批预示着未来血友病的治疗不再局限于传统的凝血因子替代疗法,业内也正积极尝试其它双特异性抗体和基因疗法,比如血液病领域领跑者Baxalta表示其正在努力推进双特异性抗体以及基因疗法产品线。
保护emicizumab的专利申请
Chugai首先开发了靶向因子IXa和因子X的双特异性抗体hBS23,非人灵长类动物模型中证实其具有止血活性,为了进一步改善其FVIII模拟活性、免疫原性、稳定性和药代动力学,Chugai利用其ART-Ig技术获得了ACE910 (即为后来的emicizumab),并在灵长类动物模型中证实了其止血活性。
保护ART-Ig技术的专利申请
ART-Ig技术通过静电转向突变 (Electrostatic steering mutations)技术来解决HC/HC的错配问题,即在两条不同重链的CH3结构域分别引入带负电和带正电的氨基酸残基,以通过静电吸引作用增加异源二聚体的形成,并通过静电排斥作用减少同源二聚体的形成。
2006年,Chugai首先递交了一件PCT国际申请 (公开号:PCT/JP2006/306803),并进入了US、CN、EP和JP等国家阶段。其中,进入US和CN国家阶段的授权专利分别为US10011858B2和CN101198698B,均保护一种多特异性抗体的生产方法,并限定了CH3结构域的一些氨基酸突变位点。
2017年,Chugai还递交了US10011858B2的延续申请US15/782256,目前处在审查阶段。
为了实现异源二聚体的高效纯化,Chugai对重链可变区的氨基酸残基进行突变,以引入等电点差异,利用等电点的差异,使用色谱柱高效纯化异源二聚体。Chugai于2007年起递交了一系列PCT/JP2007/057058衍生的专利家族来保护这一技术。
保护活性成分的专利申请
早在2006年,Chugai就递交了一个保护活性成分的PCT国际申请 (PCT/JP2006/306821),进入了多个国家阶段,涉及保护一种具有凝血因子VIII功能的多特异性抗体,限定了抗体的结构组成,没有限定具体的CDR序列。其中,进入US国家阶段的专利申请及其衍生的延续申请大部分放弃了,目前还有一个申请处于审查阶段 (US20180244800A1)。进入EP和JP国家阶段 (EP1876236B9和JP4917024B2)都获得了授权,未进入CN国家阶段。
Chugai于2011年11月又递交了一个涉及活性成分 (限定了具体的序列)的PCT国际申请 (公开号:PCT/JP2011/076486),之后进入了US、CN、EP和JP等国家阶段。
进入US国家阶段的授权专利US9334331B2保护一种双特异性抗体,权利要求1保护:
“A bispecific antibody that specifically binds to blood coagulation factor IX and/or activated blood coagulation factor IX, and specifically binds to blood coagulation factor X, wherein the bispecific antibody comprises:
a first antibody H chain comprising a variable region comprising complementarity determining regions (CDRs) 1, 2, and 3 that comprise SEQ ID NOs: 105-107, respectively;
a second antibody H chain comprising a variable region comprising CDRs 1, 2, and 3 that comprise SEQ ID NOs: 126-128, respectively; and
identical first and second antibody L chains, each L chain comprising a variable region comprising CDRs 1, 2, and 3 that comprise SEQ ID NOs: 156-158, respectively.”
US9334331B2的权利要求1保护一种结合凝血因子IX和/或活化凝血因子IX以及凝血因子X的双特异性抗体,该双特异性抗体包含第一重链、第二重链和两个相同的轻链,并对其CDR序列进行了限定,经序列比对,权利要求1的保护范围涵盖emicizumab。算上专利期调整,US9334331B2的保护期将至2032年11月。
Chugai还递交了一些US9334331B2的分案申请,仍处于审查阶段,请求保护多特异性抗原结合分子 (US20160222129A1)或编码双特异性抗体的核苷酸 (US20170022293A1)等。
进入中国国家阶段也获得了授权—CN103298937B,权利要求1保护多组双特异性抗体,并分别限定了氨基酸序列。
保护药物组合物或治疗方法/用途的专利申请
继活性成分专利家族之后,Chugai又递交了涉及emicizumab药物组合物和治疗方法/用途的PCT国际申请。比如,
PCT/JP2015/060171涉及emicizumab药物组合物,权利要求1涉及包含识别凝血因子IX和/或活化的凝血因子IX与凝血因子X和/或活化的凝血因子X的双特异性抗原结合分子,上述药物组合物用于预防和/或治疗由于凝血因子VIII和/或活化的凝血因子VIII活性下降或缺乏而发生和/或进展的疾病,并限定了给药方案。PCT/JP2015/060171已经进入了US、CN、EP和JP等国家阶段,都处于审查阶段。
PCT/JP2017/031933涉及emicizumab治疗方法/用途,权利要求1涉及通过使用识别凝血因子IX和/或活化凝血因子IX以及凝血因子X和/或活化的凝血因子X的双特异性抗体来治疗和/或降低一种疾病的发病率,该疾病由凝血因子VIII和/或活化凝血因子VIII活性降低或缺乏而引起。PCT/JP2017/031933于2018年3月刚公开,尚未在各个国家/地区授权。
保护制剂的专利申请
2017年,Chuigai递交的PCT/JP2017/016658涉及emicizumab的制剂,权利要求1中涉及的辅料成分涵盖FDA批准的Hemlibra®说明书中的辅料成分。
Emicizumab面临专利诉讼
2016年,Baxalta (血液病领域领跑者,公司股票因Hemlibra®的上市受到打击,2016年被Shire收购)在东京地区法院对Chugai提起侵权诉讼,声称Chugai的行为侵犯了其日本专利 (JP4313531),今年3月,法院作出了有利于Chugai的判决。
不过,双方在美国的专利战仍在持续。
Hemlibra®获批前,Baxalta在美国特拉华州地方法院对Genentech和Chugai提起专利侵权诉讼,声称Genentech和Chugai制造、使用、销售、许诺销售和进口Hemlibra®等行为侵犯了其专利权—US7,033,590 (保护一种可以结合因子IX或因子IXa并增加因子IXa的促凝血活性的抗体,涵盖不同形式的抗体类型)。
获批之后,Baxalta又寻求阻止Genentech向患者销售Hemlibra®的初步禁令,不过排除了急需Hemlibra®的部分患者。目前,该案件还未做出判决。
双特异性抗体热度持续上升
Emicizumab是Chugai利用其ART-Ig技术开发而成,是第三款上市的双特异性抗体。双特异性抗体可以同时靶向两种不同靶点,并应用于多个治疗领域。目前已经出现了至少23种双特异性抗体平台,未来数年可能会带来数百万美元的收益,可以预见这一领域的专利也将具有巨大的商业价值。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
