首个预防性偏头痛治疗的单抗—Erenumab
Erenumab-aooe是一种全人源IgG2单抗,能够与降钙素基因相关肽 (Calcitonin Gene-Related Peptide,CGRP)受体结合,通过拮抗与偏头痛激活相关CGRP受体的功能来预防偏头痛。
2018年5月,FDA批准erenumab-aooe (商品名Aimovig®)用于成人偏头痛的预防性治疗 (用于间隙期预防性治疗,目前已获批的大多为发作期治疗药物),是首款获批用于偏头痛预防性治疗的单抗,给药方式为皮下注射。据预测,Aimovig®在2024年的全球销售额将达到17亿美元。

CGRP—迄今为止最有效的偏头痛靶标
开发新的偏头痛疗法需求强烈
偏头痛 (Migraine)是一种出现反复轻度或重度头痛的慢性疾病,通常伴有各种自主神经系统症状。全球范围内,近15%的人 (或约10亿人)遭受偏头痛的困扰,这给社会带来极大的经济负担。超过7%的偏头痛患者的疼痛频率会随着时间的推移而增加。
目前常用的疗法包括镇痛药、曲坦类药物、β受体阻滞剂等,但这些疗法目前存在副作用大、疗效不足和患者依从性差等方面的问题,部分患者因副作用而被迫停止治疗。开发新的偏头痛疗法需求强烈。
CGRP途径
为了解决这一尚未满足的需求,人们将目光转向新的神经调节和药理学靶点。
CGRP是一种37个氨基酸的神经肽,广泛分布于中枢和外周神经系统。CGRP在偏头痛的病理生理学中起重要作用,早期研究表明颈静脉血液中的CGRP水平在偏头痛发作期间增加。因此CGRP途径拮抗剂是治疗偏头痛中最具潜力的一类疗法,预计其市场潜力将达到80至100亿美元。
此前,业界试图开发靶向CGRP途径的小分子 (所谓gepants),由于肝毒性问题,这些临床试验纷纷终止,但证实了靶向CGRP通路可有效治疗偏头痛。
后来,人们转而开发靶向CGRP通路的抗体。单抗类药物具有较长的半衰期可以降低给药频率,从而提高了患者的依从性。此外,生物药不会通过肝脏代谢,不会带来肝毒性的问题。
各巨头纷纷入局
Rinat Neuroscience (Genentech的衍生公司)最早致力于靶向CGRP途径抗体的开发,他们同时开发了靶向CGRP受体和配体的抗体,后来他们选择继续开发靶向CGRP配体的抗体—fremanezumab (现由Teva拥有)。
2007年,Amgen入局,考虑到之前靶向CGRP受体的小分子在临床试验中取得了疗效,因此Amgen选择开发靶向CGRP受体的抗体。Amgen的研发团队首先制备了CGRP受体二聚体胞外域的纯化多肽,并将其注射到转基因小鼠体内。然后从血浆中分离并筛选高亲和力的人抗体,于是获得了erenumab (代号AMG334)。这其中的难点在于获得接近天然构象的抗原。
2015年,Novartis与Amgen达成合作,共同进行erenumab的后期开发与商业化。
保护erenumab的专利申请
保护抗体活性成分的专利
2009年,Amgen于同一天递交了保护抗体活性成分的US专利申请 (授权公告号:US9102731B2)和PCT专利申请 (公开号:PCT/US2009/068858)。
保护抗体活性成分
US9102731B2
US9102731B2的权利要求1保护一种抗体:
“An isolated antibody or antigen-binding fragment thereof, wherein said antibody or antigen-binding fragment thereof specifically binds the human CGRP receptor and comprises a CDRH1 having the sequence of SEQ ID NO:73, a CDRH2 having the sequence of SEQ ID NO:74, a CDRH3 having the sequence of SEQ ID NO:75, a CDRL1 having the sequence of SEQ ID NO:42, a CDRL2 having the sequence of SEQ ID NO:43, and a CDRL3 having the sequence of SEQ ID NO:44.”
US9102731B2限定抗体结合人CGRP靶点,并分别限定了抗体重链和轻链的三个CDR序列,没有限定抗体的类型。经比对,该权利要求的范围涵盖erenumab。US9102731B2获得了691天的专利期调整 (PTA),不考虑后续专利期延长等因素,保护期将至2031年11月。
Amgen接着递交了US9102731B2的分案或延续申请,比如:授权的US9862771B2的权利要求1保护使用选择性抑制人CGRP受体的单抗抑制患者血管舒张的方法,权利要求15则保护使用同样的单抗治疗偏头痛的方法;在审的专利申请US20180142029A1涉及选择性抑制人CGRP受体的抗原结合蛋白。
PCT/US2009/068858
PCT/US2009/068858进入中国国家阶段的专利申请也获得了授权—CN102348722B,权利要求2保护特异性结合人CGRP受体的抗体,并限定了一系列抗体的CDR序列。
保护治疗用途的专利
2015年,Amgen首先以临时申请US62/152708 (申请日为2015年4月)为优先权递交了涉及治疗用途的PCT专利申请 (公开号:PCT/US2015/044479),在优先权12个月期限前,Amgen又单独递交了US专利申请 (公开号:US20160311913A1)。
PCT/US2015/044479
PCT/US2015/044479进入了包括EP、JP、CN等国家阶段,其中进入中国国家阶段的专利申请CN108156814A仍处于审查阶段。
2018年4月,申请人递交了修改版本的权利要求书,权利要求1涉及:

与修改前的权利要求相比,修改后的权利要求进一步限定了抗体的CDR序列,这些CDR序列与erenumab的CDR序列一致。
US20160311913A1
US20160311913A1原始的权利要求1涉及使用抗CGRP受体的抗体来预防或减少有需要的患者中偏头痛发生的方法,给药剂量为每个月约35 mg~约210 mg。
2018年7月,Amgen根据审查意见递交了修改后的权利要求,对权利要求进行了进一步限定:比如:将剂量限定为约70 mg~约140 mg、给药方式限定为皮下注射以及对抗体的CDR序列进行了限定等。而FDA批准的说明书中的给药方案为每个月皮下注射70 mg或140 mg (连续两次皮下注射,每次70 mg)。
也就是说,修改后US20160311913A1的权利要求保护范围与说明书中的给药方案完全对应,若获得授权则可以将erenumab的保护期限延长至2036年。
同一赛道上的其它产品竞争激烈
巨大的市场需求吸引了众多大型生物制药公司参与到CGRP药物的研发中去。
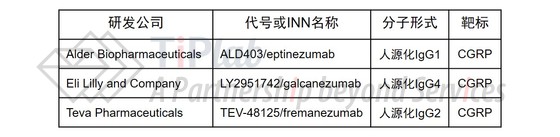
除了Amgen之外,还有三家制药公司正在进行靶向CGRP途径抗体的临床试验,分别是Alder (eptinezumab)、Lilly (galcanezumab)和Teva (fremanezumab),其中,Teva与Lilly都已经于2016年10月递交了BLA申请,Alder也将于2018年下半年递交BLA申请。
与erenumab不同,这三款抗体的靶标为CGRP配体,并且都是人源化抗体。其中,fremanezumab有望于今年获FDA的批准。
专利战已打响
2017年,Teva对Lilly提起专利侵权诉讼,请求禁止Lilly制造和销售galcanezumab。声称Lilly的行为将侵犯其一系列美国专利:US8586045B2 (治疗用途)、US8597649B2 (活性成分)、US9266951B2 (活性成分)、US9340614B2 (活性成分)和US9346881B2 (活性成分)。
2018年2月,Teva追加了一项诉讼,声称Lilly的galcanezumab落入了US9884907B2 (治疗用途)和US9884908B2 (治疗用途)的保护范围中。
这些涉案专利都来自Teva拥有的以US8007794B2为母案的专利大家族,包括至少16项专利 (申请)。双方专利战的结果还有待持续关注。
靶向CGRP (受体)抗体的市场竞争日趋激烈
考虑到巨大的市场需求,以及CGRP靶点的潜力,想要加入到CGRP拮抗剂开发的药企不仅需要探索更具竞争优势的候选药物,也应当尽早关注重要申请人的专利资产概况,提早进行侵权风险排查,为以后的知识产权策略和商业决策做准备。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
