从默默无闻到熠熠生辉
Tecfidera®是Biogen研发的一款治疗多发性硬化症(MS)的药物,自从2013年3月获得美国FDA批准上市以来,Tecfidera®凭借着更好的疗效以及更低的安全风险而销量势不可挡,迅速迈入重磅炸弹药物俱乐部。2016年,Tecfidera®的销售额达到了39.68亿美元,占Biogen全年总销售额的三成以上,是当仁不让的“收入担当”。
Tecfidera®上市后取得的巨大成功只是其传奇的一部分,而传奇的另一部分在于其活性成分—富马酸二甲酯。富马酸二甲酯(Dimethyl Fumarate,DMF)俗称霉克星1号,自上世纪80年代以来就是在工业上被广泛使用的防霉保鲜剂。试剂级的DMF目前的市场售价大约为每克1.5元人民币(而Tecfidera®的售价为每瓶(约14克)近7000美元)。那么,这种廉价的化学品是如何变成价值连城的畅销品种的呢?
“慧眼识英”的是一家瑞士的小药厂Fumapharm AG,其致力于开发富马酸酯类物质在医药领域的新用途。2003年,Biogen从Fumapharm AG获得全球独占许可,来开发和销售代号为BG-12的候选药物,并研究其在MS、银屑病等免疫系统疾病中的作用。2006年5月,随着BG-12在治疗RRMS的二期临床试验中亮眼的表现,Biogen决定斥资2.2亿美元把当时只有一个在售产品和一个在研产品的Fumapharm AG买下,从而巩固其在MS治疗领域的霸主地位。自此,又经过了将近10年,当年的BG-12才化身为如今的Tecfidera®,支撑了Biogen在MS领域的半壁江山。
那么问题来了,既然富马酸二甲酯的历史如此悠久,作为Tecfidera®活性成分的该化合物本身肯定不能受到专利保护,别的不说,化合物的新颖性这关就过不了。那么,Fumapharm及后来的Biogen是怎样进行专利布局,从而构筑竞争壁垒的呢?
Fumapharm和Biogen精心布下的局
富马酸二甲酯作为一种常用的化工原料,价格低廉,并且无法通过化合物的专利保护使Biogen获得“法定垄断地位”。那么,为了确保富马酸二甲酯摇身一变成为Tecfidera®后,价格能够增长几千倍,Biogen是如何进行专利布局的呢?下图中总结了围绕Tecfidera®的主要专利。
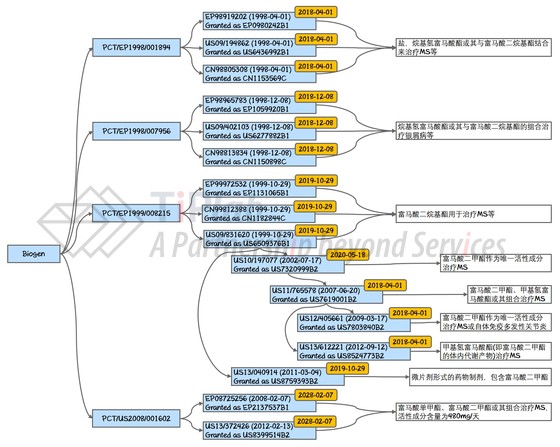
Fumapharm早期着手研究的治疗领域包括银屑病,在这方面,其于1998年12月递交了国际专利申请PCT/EP1998/007956。该申请之后陆续进入各个国家阶段,在美国(US6277882B1)、欧洲(EP1059920B1)和中国(CN1150898C)分别获得了授权。这一系列专利主要涉及烷基氢富马酸酯(富马酸二烷基酯的体内代谢产物)或其与富马酸二烷基酯的组合用于治疗银屑病、银屑病性关节炎、神经性皮炎和克罗恩氏病。因为这个系列的专利并不涉及MS,所以不保护治疗MS的药物Tecfidera®。
能够保护Tecfidera®的最早的专利申请是Fumapharm于1998年4月递交的PCT/EP1998/001894,其也分别在美国(US6436992B1)、欧洲(EP0980242B1)和中国(CN1153569C)获得了授权。这一系列专利将在2018年4月到期,它们保护的技术方案涵盖富马酸单烷基酯的盐,烷基氢富马酸酯或其与富马酸二烷基酯结合来治疗自体免疫疾病(包括MS)、移植反应等,总体而言保护范围较宽。
此外,为了保护Tecfidera®,Fumapharm还于1999年10月递交了国际专利申请PCT/EP1999/008215,其进入美国后被授权为US6509376(’376专利),而’376专利的子子孙孙们随后陆续获得授权,将分别在2018年4月至2020年5月期间到期。PCT/EP1999/008215也分别在欧洲(EP1131065B1)和中国(CN1182844C)获得了授权,这些专利将在2019年10月到期。以’376专利及其子孙为例,可以看出它们的保护范围各有侧重。老祖宗’376专利涉及微片剂或丸剂形式的药物制备物或组合物,其活性成分包括富马酸二烷基酯,适应症包括移植医学或多种自体免疫疾病,例如多发性关节炎及多发性硬化症等。
值得注意的是,’376专利不仅涵盖富马酸二甲酯,还涵盖了包括其他取代基的类似化合物,意在阻止竞争对手使用结构类似的化合物来治疗所提及的这些适应症(例如MS)。因此,’376专利涉及众多化合物及众多适应症,保护范围相当宽,要规避较为困难。相反,US8759393将药物剂型具体限定为微片剂形式,使得其成为一个较弱的专利,容易通过改变制剂形式而规避。US7619001和US8524773均涉及富马酸二甲酯的体内代谢产物甲基氢富马酸酯,并将适应症限定为MS,虽然权利要求的范围较窄,但是意在阻止竞争对手通过制备DMF的体内代谢产物来规避专利保护。US7803840和US7320999的保护范围相似,均涉及用富马酸二甲酯作为唯一活性成分,并且仅涉及治疗MS,但是应该也足以防止竞争对手直接用富马酸二甲酯来治疗MS。
可见,围绕着富马酸二甲酯用于治疗MS的这一医药用途,Fumapharm在专利保护方面布下了天罗地网,既有权利要求较宽泛的专利,又有权利要求为具体产品量身打造的“精准”保护性专利。其中,较宽泛的权利要求既涵盖了结构相似的其它化合物,也涵盖了富马酸二甲酯的体内代谢产物,而适应症方面除了涵盖MS外,也涵盖了其它免疫相关疾病。
但是,上述这些专利基本都会在2020年5月之前到期。对于Tecfidera®这样的药物,因为原料极其便宜,生产工艺又并不复杂,一旦失去专利保护,随着竞争加剧,价格必定会很快一落千丈。于是,Biogen在2008年2月又申请了一系列“剂量”专利,分别在美国(US8399514B2)和欧洲(EP2137537B1)获得授权。这些专利保护的是用富马酸单甲酯、富马酸二甲酯或其组合来治疗MS,而活性成分剂量为480mg/天。虽然这些专利的权利要求范围非常窄,但是它们同样“精准”地保护了Tecfidera®且不易规避,因为如果为了规避专利改变剂量,就会使得疗效显著变差和/或副作用显著增强。更重要的是,它们把Tecfidera®的专利保护期延长了8年,直到2028年。可见,为了尽量延长“法定垄断”期,药品的专利保护应该是一个持续的“过程”而不是一锤子买卖,研发人员与企业IP人员或专利律师间可通过持续沟通来寻找可能的保护主题,并强化保护力度。
然而,在制药行业,任何有价值的东西都几乎必然以迅雷不及掩耳之势遭到觊觎和挑战,这一切往往比想象中来得更快。
半路杀出的“程咬金”
花开两朵,各表一枝。
2012年6月,一家丹麦小公司Forward Pharma(FP)收到了来自EPO的喜讯,它的一个欧洲专利获得了授权(EP2316430B1)。然而,这个消息对于Biogen来说却是当头一棒,因为这可能使Tecfidera®成为一个侵权产品,更大的问题是,它可能使Tecfidera®的专利保护期大大缩短。
FP是一家什么样的公司呢?这家丹麦公司成立于2005年,基本上只有一个代号为FP187的在研产品, 而且这个东东还是其2010年从瑞典公司Aditech买来的。然而,FP这家公司在2016年出足了风头,一方面是因为其与Biogen之间的恩怨纠葛,另一方面是其成功在纳斯达克上市并且完成了年度第二大的生物技术公司IPO。
值得注意的是,FP最大的股东有一个分支机构叫做Nordic Biotech General Partner ApS(Nordic Biotech),而Nordic Biotech正是Aditech的实际控制者。Aditech从2004年开始开发DMF的缓释配方,并且陆续申请了一系列专利,而FP于2005年成立之初就与Aditech签订了许可协议,获得了DMF相关专利家族的许可,并且在2010年干脆从Aditech买下了这些专利(申请)。因此,在某种意义上,FP从一开始就是为了Aditech的DMF相关产品而生的。
联想到这之前不久(2003年),另一个欧洲的小公司Fumapharm通过与Biogen合作开发DMF相关医学应用获得的成功,可以说Aditech及FP的商业策略自始就是相当清晰的。
FP希望通过对剂量、剂型的改进,使FP187在疗效或副作用方面有显著改善,与此同时,FP围绕FP187构建了强大的专利保护网。这样,如果Biogen最终上市销售的产品与FP187不同,并且不在FP专利网的覆盖范围内,那么也许FP187将作为改进型产品参与未来的竞争,而届时作为MS界霸主的Biogen(或其直接竞争对手)也许会考虑买下FP187相关权利甚至FP公司。如果Biogen最终上市销售的产品落入了FP的专利网之内,FP就可以通过收取专利许可费从Biogen的销售额中分成。下图中总结了围绕FP187的主要专利。
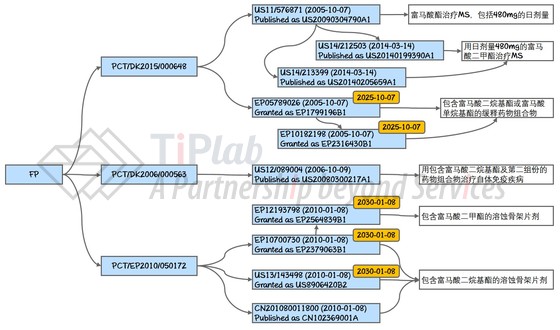
保护FP187的核心专利家族始于Aditech在2005年10月递交的国际申请PCT/DK2005/000648,其目前在欧洲获得授权(EP1799196B1及EP2316430B1),而美国的申请还处于在审状态(US11/576,871及其延续申请们)。这些专利(申请)均涉及用日剂量480mg的富马酸二甲酯治疗MS。如果获得授权并被维持有效,这些专利将在2025年10月到期。
FP的另外一个专利家族涉及包含富马酸二烷基酯的溶蚀骨架片剂,这一族均源自FP于2010年1月递交的国际申请PCT/EP2010/050172,并且在美国(US8906420B2 )和欧洲(EP2379063B1及EP2564839B1)均获授权,而在中国的申请(CN102369001A)仍然在审。这一系列专利如果被维持有效,将在2030年1月到期。
FP还在2006年就富马酸二烷基酯与其它药物连用的药物组合物申请了专利保护(PCT/DK2006/000563)。
面对FP这个半路杀出的“程咬金”,Biogen会如何应对呢?而FP又将如何回应呢?
冤家宜解不宜结
首先,Biogen方面主动出击。2013年,针对FP已获授权的欧洲专利(EP2316430及EP2379063),Biogen在9个月异议期即将结束时分别提出了异议请求,其中属于核心家族的EP2316430在异议程序中被撤销,而保护溶蚀骨架片剂的EP2379063在异议程序中被维持有效。针对这些结果,双方都还在继续上诉中。
另一方面,FP一方也积极反击。其先是于2014年2月针对Biogen的欧洲专利EP2137537(即“剂量”专利)提出了异议请求,而该专利在2016年6月被EPO撤销,目前Biogen还在继续上诉中。另外,FP于2014年11月在德国针对Biogen销售的Tecfidera®提起专利侵权诉讼,并且战火后来又蔓延到了欧洲的其它国家。
在美国,FP与Biogen也就“谁先发明了用480mg日剂量的DMF治疗MS”的问题争得不可开交(于2015年4月启动了专利抵触程序)。
2017年1月17日,FP与Biogen就侵权纠纷达成了和解,Biogen同意向FP支付12.5亿美元的先期付款,并且取决于美国和欧洲目前仍在进行的专利纠纷情况,可能需要继续向FP支付专利许可费。消息一出,FP的股价从9.36美元狂飙至27.21美元。至此,FP长达十余年的努力终见成效,而Biogen围绕Tecfidera®构筑的专利壁垒也进一步得到了巩固,对双方而言,这都是一个还不错的结果。下图总结了FP与Biogen这些年来的纠葛。
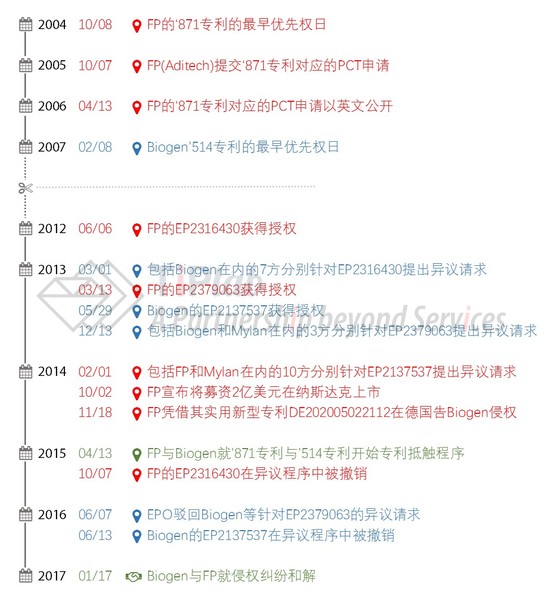
但是,与FP的和解也许并不能使Biogen从此高枕无忧,江湖中仍然危机四伏。如果看一下针对FP的EP2316430以及针对Biogen的EP2137537提出异议请求的情况,就可以了解到,异议请求人分别多达7个和10个,其中不乏Mylan、Zentiva(赛诺菲旗下)、Actavis等仿制药公司的身影,可以说未来仍然有诸多变数,而Biogen若想把垄断性竞争优势保持到2028年,恐怕还有很多场硬仗要打。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
