生物医药由于研发过程漫长,需要不断地进行研究试验,不断地改进发明的技术方案;同时,由于产品研发成本高昂,需要尽可能地延展专利所带来的药品保护期限。一方面,优先权作为专利申请保护策略的有效工具,可以被应用于进行周密的专利布局;另一方面,优先权作为药品生命周期管理的有利手段,可以“推延”药品的专利保护期限。由此可见,在生物医药专利领域,巧妙地利用优先权是使医药研发企业利益最大化的重要方式之一。
然而由于生物医药技术方案较为复杂,发明技术方案的“改进版”一直在更迭和变化中,同时生物医药领域的发明人有投稿SCI的迫切需求,常有相关的在先申请和出版物公开发表,因此,生物医药领域的优先权比较难界定。换言之,该领域的优先权的认定问题一直比较模糊。
近期专利复审委评选出了2019年度专利复审无效十大案件,其中“用于治疗糖尿病的二肽基肽酶抑制剂”系列专利无效宣告请求案对生物医药领域的优先权认定给出了明确的认定方式。我们可以通过这一典型案例,了解近期复审委对生物医药领域优先权的认定的评判标准。
案件基本情况
“用于治疗糖尿病的二肽基肽酶抑制剂”相关专利无效宣告请求案涉及三件内容极为相关的专利(无效宣告请求审查决定号分别为第38950、38951和38952号),它们的专利权人为武田药品工业株式会社(下称武田制药),无效宣告请求人为亚宝药业集团股份有限公司。
这些专利涉及用于治疗糖尿病的二肽基肽酶抑制剂(DPP-4抑制剂)。目前已上市的DPP-4抑制剂包括西格列汀、维格列汀、沙格列汀、利格列汀、阿格列汀等。其中阿格列汀(商品名尼欣那,Nesina)是武田制药于2005年研发的一种口服抗糖尿病药,其控糖效果好,且不会增加心血管疾病和心脏病的风险,于2013年在中国上市。
我们将以涉案专利1和涉案专利2为例探讨优先权的认定问题:
涉案专利1名称为“用于治疗糖尿病的二肽基肽酶抑制剂”(专利号:ZL200680042417.8,申请日2006年9月13日,优先权日2005年9月14日),其授权公告时的权利要求1为: 1、配制成单剂量形式的药物组合物,其中该单剂量形式含有5毫克和250毫克之间的化合物I,化合物I具有下式结构,
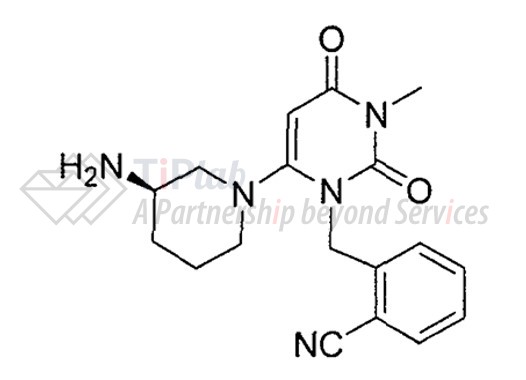
其中化合物I以药学上可接受的盐或以游离碱形式存在。
涉案专利2名称为“用于治疗糖尿病的二肽基肽酶抑制剂”(专利号:ZL201210332271.8,申请日2006年9月13日,优先权日2005年9月14日),其授权公告时的权利要求1为:
1、药物组合物,其包含具有下式结构的化合物I和药学上可接受的载体,

其中化合物I以药学上可接受的盐或游离碱的形式存在,并且以5毫克至250毫克的日剂量给药。
优先权的认定
无效请求人认为涉案专利1和涉案专利2无法要求优先权。无效请求人提供了证据4(WO2005095381 A1,申请日为2004年12月15日,因此其申请日早于本专利所要求的最早优先权日)。证据4是专利权人自己提交的公开文本,公开了与涉案专利1-2相同主题的发明,因此涉案专利1-2的要求享有优先权的在先申请并非首次申请,其主张的优先权日不能成立。
那么专利法是如何规定享有优先权的条件的呢?
专利法第29条第1款
申请人自发明或者实用新型在外国第一次提出专利申请之日起十二个月内,又在中国就相同主题提出专利申请的,依照该外国同中国签订的协议或者共同参加的国际条约,或者依照相互承认优先权的原则,可以享有优先权。
可见决定是否享有优先权的关键在于什么是真正的“相同主题”的技术方案?换言之,关键在于证据4是否披露了涉案专利1-2相同主题的发明。
复审委认为,优先权中涉及所谓“相同主题”需要考虑在先申请和在后申请二者所属技术领域、所解决的技术问题、为此所采用技术方案和预期能够达到的技术效果是否均相同。
其中,“相同主题”是指在先申请作为一个整体披露了在后申请技术方案的各个技术特征和整体技术方案。换句话说,本专利中的某个技术方案需要记载于在先申请所公开的内容中,而非在先申请的某项权利要求中。
在某些情况下,在先申请并没有记载某一技术方案中的一个技术特征,或者对这个技术特征仅仅是泛泛而谈地进行了描述,然而在后申请增加了对该技术特征的具体描述/限定。那么,此时所谓“相同主题”与否的依据在于判断在后申请所增加的针对该技术特征的具体描述/限定对本领域技术人员而言,是否能够从在先申请所公开的内容中直接地、毫无疑义地获得,若能获得,则属于“相同主题”,反之,则不属于。
此外,复审委指出,在判断“相同主题”时,这个关键的“技术特征”必须是对技术方案具备实质限定作用的技术特征,如果某一技术特征对权利要求不具备限定作用,那么就不应该把这个技术特征纳入技术方案的对比范畴,该特征也就不能“参与”上述的判断。
涉案专利1
回到涉案专利1,证据4披露一类具有抑制DPP-4的活性的化合物,其中第85页第一个实施例记载的制备的目标化合物4即为涉案专利1的化合物I。第78-79页“制剂实施例”部分公开了制剂例(口服制剂、静脉内制剂和片剂)。
证据4没有记载口服制剂用于单次给药的产品形式。同时,证据4页没有披露药物组合物中化合物I的含量范围为5-250mg。因此,证据4没有披露与涉案专利1权利要求1相同的主题,不能影响权利要求1享受优先权。
根据合议组对涉案专利1享有优先权的正面态度,可见合议组认为权利要求1中“单次给药的产品形式”的技术特征是有限定作用的。而承认该技术特征具备限定作用,也就意味着承认该“用药特征”带来了产品组成和形态变化。
这是因为涉案专利1的说明书第0166段记载,“该药剂盒也可以包括单剂量或多剂量形式的组合物”。这意味着单剂量形式是涉案专利1的权利要求1所述的药物组合物的一种具体的表现形式。换言之,“单次给药的产品形式”能够区别于包含多个剂量适合多次给药的多剂量形式的产品,其实质上是一种产品限定的技术特征而非给药方式的技术特征,因此对涉案专利1的权利要求1具有限定作用。
涉案专利2
针对涉案专利2,在判断优先权认定涉及的“相同主题”时,这个关键的“技术特征”为口服日剂量为5毫克至250毫克。然而,这个技术特征属于给药特征,仅体现在医生的用药过程中,对药物的组成和结构没有限定作用,因此,这个技术特征对涉案专利2的权利要求1不具备限定作用,不能将“口服日剂量为5毫克至250毫克”的特征纳入优先权认定的考虑范围。
此时,由于证据4披露了包含涉案专利2的化合物I的药物组合物,并且该药物组合物用于治疗已知受DPP-4的介导或者已知用DPP-4抑制剂治疗的疾病状态,因此,证据4记载了使用涉案专利2的权利要求1相同的技术方案。
此外,本领域技术人员根据证据4的整体记载可以确认具有DPP-4抑制活性意味着可以降低血糖,治疗糖尿病,因此,涉案专利2记载的降血糖研究相对于证据4已验证的DPP-4抑制活性的技术效果而言,没有产生新的技术效果,因此涉案专利2的权利要求1和证据4具有相同的技术效果。
在技术方案和技术效果相同的基础上,结合证据4和涉案专利2的权利要求1均属于糖尿病治疗的技术领域,因此,证据4和涉案专利2属于相同主题的发明,因此,涉案专利2要求享有优先权的申请并非首次申请,涉案专利2不享有这些在先申请的优先权。
TiPLab说
上述的涉案专利1-2通过正面/负面两个不同的优先权认定结果,让我们对复审委判断在后申请是否享有在先申请优先权的判断标准有了一个大致的认知。
即判断在先申请和在后申请二者所属技术领域、所解决的技术问题、为此所采用技术方案和预期能够达到的技术效果是否均相同。在判断技术方案是否相同时,在先申请的比较范围不限于权利要求,而是整个申请文件。
同时,在判断技术方案是否相同时,在后申请中的技术特征必须是对其权利要求真正起到限定作用的技术特征。即如果是产品权利要求,需要对产品的结构和/或组成产生限定作用的技术特征。否则,这样的技术特征是“不适格”的,无法起到判断在先申请和在后申请的技术方案是否“具有相同主题”的作用。
在生物医药领域,一些技术特征表面上是“给药特征”,但是本质上能够起到对产品组成/结果限定的作用,因此其本质为产品特征,能够作为“适格”的技术特征用以判断优先权相关的“相同主题”,反之,真正意义上的给药特征(例如给药间隔、给药剂量、给药对象)在中国不被认为对药物产品有任何的限定作用,因此也对优先权的认定不起到作用。
可以看到优先权的认定和新颖性的判断存在一定的可类比之处。如果所谓在后申请的技术方案被早于在先申请的另一篇专利申请所记载,那么在先申请“作为本国优先权基础的中国首次申请”的地位就受到了威胁。而在后申请的技术方案与这另一篇专利申请的比对结果,不仅取决于技术方案本身,也取决于技术领域和技术效果。从这个角度而言,优先权的认定比新颖性的判断要更“宽松”。同时,在后申请的技术方案中涉及的更为明确的技术特征的判断依据在于基于在先申请记载的内容能够“直接、毫无疑义”地获得,这就是说并不需要在先申请从字面和意思上必须有“一模一样”的对应记载,从这个角度而言,优先权的认定也比新颖性的判断要更为“宽松”。
涉案专利1-2的命运为生物医药领域专利优先权的认定提供了一个重要示范,也为专利布局,尤其是在先申请记载内容的取舍提供了重要的参考。在在先申请,尤其是其说明书的具体实施部分,将关键的技术特征阐述到怎样的一个程度能够不影响在后申请的优先权认定,需要在撰写在先申请时就想好退路,埋好伏笔。这就对整体规划好专利申请布局提出了更高的要求,需要专业人士提供相应的帮助。
*以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
