长盛不衰的江湖神话
阿达木单抗(Adalimumab,商品名:Humira®)是由艾伯维(AbbVie)开发的一种抗体药物,它能够结合肿瘤坏死因子-α(TNFα),是一种TNF抑制性生物药。通常情况下,TNFα结合TNFα受体,从而导致自身免疫性疾病的炎性反应。阿达木单抗通过结合TNFα,能够减少这种炎性反应。2002年12月,美国FDA首次批准Humira®用于治疗类风湿性关节炎,随后,经美国FDA陆续批准的适应症还包括:银屑病关节炎、强直性脊柱炎、克罗恩氏病、溃疡性结肠炎、慢性牛皮癣、化脓性汗腺炎和幼年特发性关节炎等。截至2015年,Humira®在全球范围内被批准的适应证已扩展到13个。2011年11月,CFDA首次批准Humira®用于治疗类风湿关节炎,而到目前为止,其在中国获批的适应症只有两个,即类风湿关节炎和强直性脊柱炎。
阿达木单抗最初由BASF和Cambridge Antibody Technology(CAT,现为AstraZeneca)合作开发。故事始于1994年,CAT首先使用噬菌体展示技术获得了结合TNFα表位的全人抗体,命名为D2E7(即今天的adalimumab)。1998年,BASF制造了该抗体并进行了针对类风湿性关节炎的I期临床试验。2001年2月,雅培(Abbott)以69亿美元收购了BASF的制药业务,由此不仅加强了其在治疗心血管疾病、代谢疾病和减缓疼痛等药物方面的现有产品组合,还扩充了研发管线。在这些品种中,最令人兴奋的就是用于治疗类风湿性关节炎的产品D2E7,当时该产品正处于关键性的III期临床试验阶段,雅培将负责其进一步的开发、制造和销售。
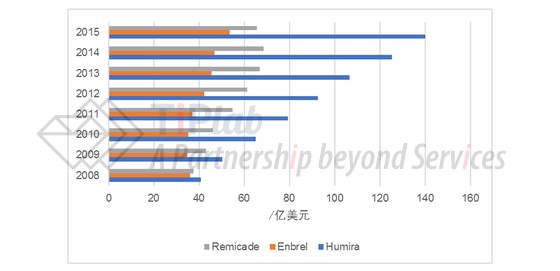
2002年4月,雅培基于23个临床试验的数据向FDA提交了D2E7的生物制品许可申请(BLA)。同年12月份,FDA批准了D2E7用于治疗类风湿性关节炎的应用,自此,Humira®成为了FDA批准的第一个全人单克隆抗体药物。此后,雅培不断扩大Humira®的适应症范围(13个适应症),并伴随着销量的不断增长一路披荆斩棘稳坐冠军宝座。2013年,雅培一分为二,由艾伯维负责Humira®的进一步开发和销售。据统计,从2012年至2016年,Humira®始终位于畅销药品名单前列,并在2016年达到了160亿美元的全球销售额。Humira®是继Remicade和Enbrel之后,获得美国FDA批准的第三种TNF抑制剂类药物。虽然上市较晚,但Humira®的销量以绝对优势遥遥领先(见下表1的比较),“药王”的称号当之无愧。
有趣的是,雅培收购BASF时虽然获得了其D2E7的相关知识产权,但并未获得CAT的相关专利权益。后来,CAT向雅培提起诉讼,认为雅培同意支付的专利许可费用过低。最终双方达成庭外和解,为此雅培付出了2.55亿美元的代价。在生物医药领域,知识产权作为阻止竞争对手的有力武器能够以无形的力量将竞争者拒于市场之外,不难猜测雅培势必为“药王”构筑起了强大的专利壁垒,让我们来一探究竟吧。
量身打造的专利盾牌
美国
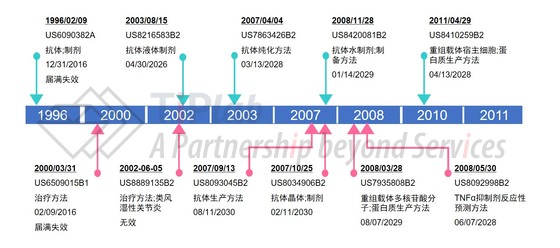
在美国,BASF于1996年提交了第一个保护阿达木单抗的核心专利申请,并获得授权(US6090382),在该专利披露的方法中,通过噬菌体展示技术获得了TNFα的全人抗体D2E7抗体(即阿达木单抗),最大程度地克服了鼠源抗体的缺陷,权利要求对抗体本身和包含该抗体的制剂进行了保护。US6090382获得了326天的PTE(Patent Term Extension)专利期延长,到期日延长至2016年12月31日,目前该专利已经届满失效。2000年3月,BASF提交了US6090382的延续申请(Continuation application)并获得了授权(US6509015),该专利保护使用抗体抑制TNFα活性的方法,同样也已届满失效。2002年6月,艾伯维(雅培)递交了针对治疗方法的专利并获得授权(US8889135),该专利保护每13至15天皮下注射40 mg抗体治疗类风湿性关节炎的方法,不过该专利已被美国专利审判及上诉委员会(PTAB)无效。
2003年8月,艾伯维(雅培)递交了针对抗体液体制剂的专利申请并获得了授权(US8216583),该专利保护D2E7抗体的稳定液体制剂,保护期至2026年4月30日。随后艾伯维(雅培)又对抗体的液体制剂进行了改进,得到了低电导率的高浓度抗体液体制剂,并获得了专利授权(US8420081)。US8420081将Humira®的专利保护期延长至2029年1月14日。
2007年至2011年期间,艾伯维又申请了一系列外围专利,分别对抗体纯化方法(US7863426)、TNFα抑制剂反应性预测方法(US8092998)、重组载体(US7935808及其延续申请US8410259)、抗体生产方法(US8093045)和抗体晶体(US8034906)进行了保护,从而为Humira®持续保持垄断地位保驾护航,缓解核心专利到期面临的竞争压力。这些外围专利的到期日覆盖2028年至2030年,从而将Humira®的专利保护期延长至2030年8月11日。
欧洲
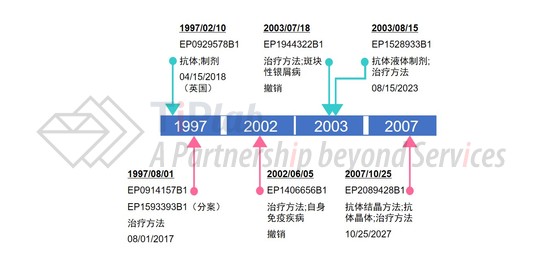
接下来,让我们看看欧洲市场的专利保护情况。BASF于1997年提交了核心专利申请并获得授权(EP0929578),该欧洲专利后续进入了若干EPC成员国。以英国为例,基于补充保护证书(Supplementary Protection Certificate,SPC),该专利在英国的保护期延长至2018年4月15日。同年,Kennedy Institute of Rheumatology递交了保护TNFα抗体和甲氨蝶呤组合疗法的专利申请,并获得授权(EP0914157及其分案EP1593393),这两项专利均覆盖了阿达木单抗的使用方法。为此,艾伯维(雅培)为EP0914157的美国同族专利US6270766支付了高达1亿美元的专利许可费。不过Kennedy Institute of Rheumatology并不满足于此,于2010年就US6270766的延续专利US7846442向艾伯维(雅培)提起专利侵权诉讼,要求艾伯维(雅培)进一步支付该延续专利的许可费用,而艾伯维(雅培)方认为US7846442与US6270766属于重复授权的专利,最终法院判定US7846442的部分权利要求无效。
2002年,艾伯维(雅培)针对阿达木单抗在治疗自身免疫疾病方面的用途提交了专利申请并获得授权(EP1406656),具体保护40 mg剂量的TNFα抗体治疗自身免疫疾病的用途,是典型的“用途限定的产品”类型权利要求。虽然该专利限定了具体的剂量,保护范围比较窄,但仍能够精准地保护Humira®这个产品,且不易规避,因为剂量对于药物的疗效而言十分重要。正因为如此,EP1406656这个看起来保护范围较窄的专利遭遇了激烈的挑战。自2013年10月以来,Amgen、Pfizer、Teva、STRAWMAN等15方陆续通过异议(Opppsition)程序对EP1406656专利发起挑战,最终EPO于2015年11月决定撤销该专利。 EP1944322是与EP1406656类似的一个保护TNFα抗体治疗斑块性银屑病的用途专利,该专利申请于2003年7月递交,2015年3月授权,不过也难逃被异议的命运。自2015年12月起,由Amgen、Generics、Teva、Pfizer等13方联合挑起了针对EP1944322的专利异议程序,最终EPO于2017年4月做出了撤销EP1944322专利的决定。
艾伯维(雅培)还于2003年申请了保护抗体液体制剂的专利(EP1528933),并于2007年申请了保护抗体晶体的专利(EP2089428),这些专利与对应的美国专利分别属于相同的专利家族。EP1528933和EP2089428分别于2023年8月15日和2027年10月25日到期。
由上文的分析可以看出,艾伯维(雅培)针对Humira®在美国和欧洲都进行了广泛的专利布局,那么中国的情况又如何呢?
中国
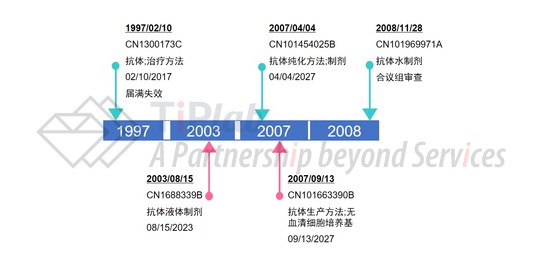
首先,BASF在中国获得授权的核心专利(CN1300173)与相应的EP专利同属于一个专利家族,已经于2017年2月10日到期。之后,艾伯维(雅培)在中国提出的围绕Humira®的外围专利(申请)主要保护抗体液体制剂、抗体纯化方法和抗体生产方法。这三个专利的共同点是保护范围都比较宽泛,独权中没有明确限定抗体的种类为阿达木单抗。更重要的是,这三个专利将Humira®的专利保护期限延长至了2027年9月13日。艾伯维(雅培)在2008年11月提交的保护抗体液体制剂的专利申请目前仍在审而未授权(被驳回后处于复审阶段),若该申请最终能被授权,那么将使得Humira®的专利保护期延长至2028年11月28日。
纵然艾伯维(雅培)围绕Humira®构筑了强大的专利壁垒,但随着核心专利的到期,在“药王”带来的巨大市场利益的驱使下,艾伯维(雅培)与竞争对手之间的专利纷争必然不断升级。
愈演愈烈的专利战
随着保护Humira®的核心专利过期,全球仿制药企业的研发积极性达到白热化程度。据不完全统计,目前已有12家企业的阿达木单抗仿制药推进至临床III期,且安进(Amgen)的首个仿制药Amgevita已经于2016年9月23日和2017年3月23日分别获得了美国FDA和欧盟EMA的批准。在此之前,艾伯维与安进之间的专利战早就轰轰烈烈地上演了。
2009年出台的“生物制品价格竞争与创新法案”(BPCIA)提供了一套解决围绕生物仿制药与原研药专利纠纷的程序,称之为“专利舞蹈”(Patent Dance)。原研药与生物仿制药制造商之间需要通过至少两轮诉讼或和解过程来完成专利信息的交换。2016年2月艾伯维和安进开始进行专利舞蹈,双方通过谈判后事先确定了10项专利作为第一轮诉讼的专利清单。2016年8月4日,艾伯维根据BPCIA的规定在美国联邦特拉华地区法院对安进提起了专利侵权诉讼。艾伯维声称安进的仿制药侵犯了双方事先确定好的十项专利权,并向法院请求一旦FDA批准安进的相关产品上市销售,法院应当立即发出禁令,制止安进的侵权行为。艾伯维还请求强制安进提供BPCIA所规定的180天商业上市前通知。
除了发生在联邦地区法院的侵权纠纷之外,在美国专利商标局(USPTO)的专利战也早已拉开帷幕。安进于2015年6月26日曾向美国专利审判及上诉委员会(PTAB)提出过双方复审程序(Inter Partes Review, IPR)的请愿书,认为艾伯维的制剂专利US8916157和US8916158缺乏新颖性和创造性。这两个专利都是US8216583衍生而来的延续申请案,保护抗体的液体制剂,原本都将于2022年到期,是继核心专利过期后能够阻止竞争对手的强力武器。2016年1月,PTAB认为安进提供的证据不足,拒绝了其IPR请求。不过,安进表示不会就此放弃,将继续挑战这两项专利的有效性。
当艾伯维还在与安进周旋时,Coherus也来凑热闹。2015年11月10日,Coherus提交了一份IPR请求,挑战艾伯维的方法专利US8889135不具备新颖性。12月7日,Coherus继续声明艾伯维的方法专利US9017680和US9073987是显而易见的,其中US8889135、US9017680和US9073987均要求保护治疗类风湿性关节炎的方法。12月29日,Boehringer Ingelheim也提交了两份IPR请求,同样针对US8889135,都认为权利要求1到5不具备创造性。2017年5月17日,Coherus在对艾伯维的其中一轮专利挑战中胜出,PTAB无效了艾伯维的方法专利US8889135。而其它两份IPR请求已由PTAB接受并在审理过程中,预计结果将在不久后揭晓。
毫无疑问,随着各专利的到期日临近,艾伯维还有很多场硬仗要打。目前,Humira®的一大半收入来自于美国市场,因此其在美国也进行了更为顽强的防守。在2013年与雅培分开后,艾伯维又新申请了20多项专利,如果这些专利得到授权,将进一步加强围绕Humira®的专利壁垒。另一方面,各仿制药企业的决心也势不可挡。虽然目前安进的冲击受阻,但随着围绕Humira®的专利诉讼数量增加,艾伯维将面临着更大的压力。
在欧洲市场,情况对于艾伯维似乎更加不利。一方面,核心专利到期就在眼前,另一方面,后续的重要专利已被对手通过异议程序成功无效。预期在不远的将来,围绕Humira®的市场竞争必将愈加激烈。
在一大波仿制药企业前赴后继的冲击下,艾伯维在这场旷日持久的专利战中能够坚持多久还需拭目以待。Humira®的出现毕竟是前无古人,其辉煌成就恐怕一时也难以被超越,无论结局怎样,都无疑是制药业历史上极为璀璨的一页。
中国仿制药研发同样呈现井喷之势
我们再来看看中国的相关研发情况。虽然中国市场在治疗类风湿类关节炎方面似乎更青睐依那西普,但Humira®耀眼的销售业绩还是吸引国内厂家掀起了一波又一波研发热潮。据统计,国内Humira®的仿制厂家也已达21家,并有至少五家企业已推进至临床试验阶段,包括复宏汉霖、百奥泰、信达生物、海正药业和丽珠单抗,其中信达生物、海正药业和百奥泰的三项试验已进行至临床III期,争夺“第一名”的竞争也不可谓不激烈。此外,艾伯维针对克罗恩病和银屑病这两种适应症在中国分别完成了临床II期和临床III期试验,预期不久之后会获批上市。目前,中国还没有相关的专利诉讼发生,不过,相信艾伯维在维护自己的权益方面会保持强势的作风。

* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
