反义寡核苷酸药物—Spinraza®
脊髓性肌萎缩 (Spinal Muscular Atrophy,SMA)是一种罕见的遗传性神经退行性疾病,由单基因运动神经元存活基因SMN1缺陷引起,无法产生足够的SMN蛋白,根据SMN蛋白缺失程度会造成肌肉无力甚至瘫痪。
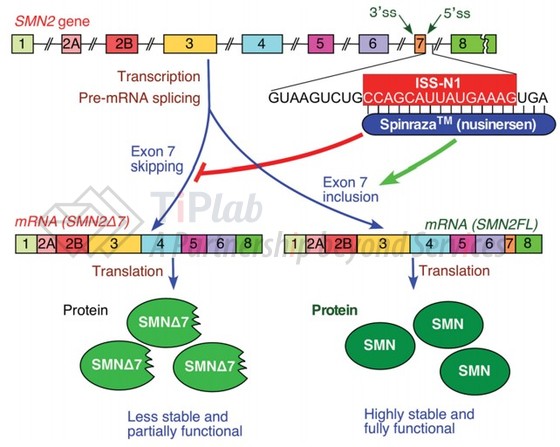
SMN1与SMN2基因均能合成SMN蛋白,但SMN2基因在RNA剪接时容易形成截断而不完整的短信使核糖核酸,使其产生正常SMN蛋白的效率较低。
Spinraza® (活性成分:nusinersen)是一种经修饰的反义核苷酸 (antisense oligonucleotide,ASO),治疗5q SMA,5q SMA是该病最常见的形式,约占所有SMA病例的95%。
Spinraza®最早由冷泉港实验室和Ionis Pharmaceuticals合作开发而成,2015年,Biogen从反义技术的领先企业Ioni获得诺西那生钠注射液在全球的开发、生产和商业推广权利。
Spinraza®通过与SMN2外显子7的剪切位点结合,降低它在剪接中被截断的机会,增加全长SMN蛋白的产生,从而治疗疾病。之前我们讨论过的Zolgensma®则是一种基因替代疗法,使用AAV9将正常SMN1基因导入患者体内,取代缺陷型SMN1基因。
Spinraza®在2011年开始展开在人体的临床试验,因其效果显著,短短5年时间,就获得FDA批准。
2016年12月,FDA批准了Spinraza®,作为首个用于治疗儿童和成人SMA的新药,以费用高昂著称,目前在美国的定价为首年75万美元,之后每年37.5万美元。2018年的销售额为17.24亿美元。。
2018年8月,药品审评中心将Spinraza®列入《境外已上市临床急需新药名单》中,2019年2月,Spinraza®通过优先审评审批程序获得国家药监局批准,正式在中国上市。
作为一种首款疗法,它的开发史通常都伴随着无数科学家的辛勤工作,Spinraza®的开发也不例外,下面我们聊聊Spinraza®开发的一些里程碑事件和代表性专利。
从里程碑事件看重要专利资产
伴随Ionis在反义寡核苷酸的研发历程,其专利资产的范围呈现由宽泛到精准的趋势,分别涉及寡核苷酸的化学修饰方法、与产品无关的宽泛治疗用途、不依赖于化学修饰的反义寡核苷酸序列和特定的产品结构。这为竞争对手设下了重重障碍。
涉及寡核苷酸修饰技术的平台专利
Spinraza®包括两种化学修饰:其呋喃核糖基环上的2-羟基被2’-氧-2-甲氧乙基 (2’-O-2-methyoxymethyl group)所取代;其磷酸二酯键也被硫代磷酸酯键取代,这些修饰使得反义寡核苷酸不易被分解,提高了体内的稳定性。
Ionis在早期开发了多种寡核苷酸的化学修饰技术,包括:应用到Spinraza®的2’-氧-2-甲氧乙基 (MOE)修饰技术。
美国专利US7101993B1 (1992年递交,有效期预计到2023年)涉及2’-O-修饰嘌呤的寡核苷酸,独立权利要求分别涵盖了经取代的鸟嘌呤和腺嘌呤。
揭示Spinraza®机理的Bennett专利
C. Frank Bennett博士是从事反义研究的科学家,目前担任Ionis的高级副总裁。
C. Frank Bennett作为发明人的一些专利涉及反义调节mRNA机理。
比如:1999年递交的US6210892B1的权利要求1涉及一种调节选择的野生型细胞mRNA靶的加工的方法,所述方法包括将具有以下特征的反义化合物与所述靶结合:至少一个2’-甲氧基乙氧基、2’-二甲基氨基乙氧基乙氧基、2’-二甲基氨基乙氧基乙氧基等,其与所述mRNA靶标特异性杂交,并且在结合后不引起mRNA靶标的切割,从而调节所述mRNA靶标的加工。

马萨诸塞大学医学院发现SMA的反义寡核苷酸治疗靶标ISS-N1d
2004年,马萨诸塞大学医学院发现内含子剪接沉默子N1 (intronic splicing silencer N1,ISS-N1)是SMN外显子7剪接调控的主要抑制元素。
马萨诸塞大学医学院获得的US7838657B2 (2005年递交)涉及靶向ISS-N1且不依赖于化学修饰的反义寡核苷酸。权利要求1仅限定了寡核苷酸长度和其互补序列即靶标ISS-N1的序列,并未限定寡核苷酸本身的具体序列,也就是说,对于竞争对手来说,只要生产或销售一种靶向ISS-N1的寡核苷酸就具有一定的风险。

马萨诸塞大学医学院还获得了多个US7838657B2的延续案,涉及增加细胞中含外显子7的SMN2 mRNA水平的方法等保护主题。
2010年,Ionis获得了相关专利的独占许可。
冷泉港实验室和Ionis合作开发nusinersen
冷泉港实验室的Adrian Krainer团队与Ionis制药合作开发能提高SMN信使核糖核酸的反义寡核苷酸,而这些反义寡核苷酸当中效果最好的一个成为了后来的nusinersen。Krainer团队与Ionis制药继续合作,并在动物身上验证nusinersen的治疗效果,发现它能延长患病小鼠的寿命达七倍。
冷泉港实验室和Ionis作为共同申请人构建了PCT/US2006/024469 (2006年递交)专利家族,涉及具有MOE修饰的反义寡核苷酸或其促进细胞、组织或器官的SMN2转录物中包含exon7的方法。
其中,US8361977B2的权利要求1限定反转录寡核苷酸的靶标序列、靶向区域的位点以及其包含MOE修饰。

如何突破重重专利障碍
虽然领域内的先行者已经划定了从宽泛到精准的权利范围,并不意味着别人不能进入这个领域,不过在此之前,有必要关注该领域的相关重要专利,了解在不同地域的权利范围和保护期限,在制定产品研发策略和商业化策略过程中做到心中有数,并尽可能降低风险。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
