猜到了开头却没猜到结尾的Celera
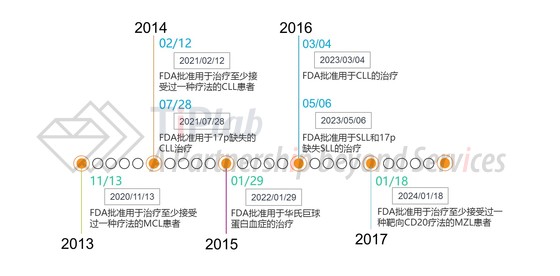
依鲁替尼(Ibrutinib商品名:Imbruvica®)是一种小分子药物,能与Bruton酪氨酸激酶(BTK)结合从而抑制其活性。BTK是B细胞受体信号传导复合物中的关键信号分子,其在恶性B细胞的存活和扩散中起重要作用,依鲁替尼通过结合BTK能够抑制恶性B细胞的增殖和扩散。自2013年11月以来,FDA先后批准Imbruvica®用于治疗慢性淋巴细胞白血病(CLL)、套细胞淋巴瘤(MCL)、华氏巨球蛋白血症(WM)、小淋巴细胞淋巴瘤(SLL)和边缘区淋巴瘤(MZL)五个适应症。此外,依鲁替尼在MCL、17p缺失的CLL和WM三种适应症批准过程中均获得了FDA突破性疗法认证(breakthrough therapy designation,BTD)。
依鲁替尼最初是由基因测序公司Celera Genomics的科学家设计合成的,来自中国的潘峥婴博士(目前就职于北京大学深圳研究生院)参与了这项工作,但当时Celera只是将依鲁替尼作为研究BTK功能的工具化合物。Celera发现这个化合物通过共价结合BTK而使BTK失去活性,这可能并不是一个好迹象,因为B细胞蛋白在那时并不认为是一个很好的疾病靶点,而且在制药行业中共价作用的化合物很少能够真正发展成为药物,因此Celera决定卖掉它。在得知这一消息后,Pharmacyclics的创始人Richard Miller博士,一名血液癌症专家,凭借其专业敏感性看到了这个化合物的可能前景。于是,Pharmacyclics在2006年4月买下了Celera Genomics用于治疗癌症和其他疾病的一些小分子候选药物以扩充其管线。根据协议条款,Pharmacyclics将拥有Celera的靶向组蛋白脱乙酰(HDAC)酶抑制剂、选择性HDAC酶抑制剂、Factor VIIa抑制剂和B细胞酪氨酸激酶抑制剂(BTK抑制剂,即后来的依鲁替尼)的相关技术和知识产权。Pharmacyclics为此仅付出了200万美元和最多达100万股股票作为先期付款,此后还将支付一定的里程碑付款以及分享未来的销售提成。
不过,Pharmacyclics起初并没有重视这些小分子化合物,直到其重点研发的药物Xcytrin遇到重重困难而使公司一度频临绝境,他们才将目光转向了从Celera获得的这些化合物。得益于精心设计的临床开发战略,BTK抑制剂依鲁替尼在临床II期表现出了十分振奋人心的结果。2011年底,Pharmacyclics宣布和强生公司达成高达10亿美元的合作计划共同开发依鲁替尼药物,由此摆脱了糟糕的财政状况,而强生也获得了依鲁替尼上市后在美国以外地区的商业化权利。2013年该药顺利获批上市并在次年就赚了5.4亿美元。
2015年3月4日,艾伯维(AbbVie)以每股261.25美元,共计210亿美元的价格收购了当时只有一个上市产品Imbruvica®的Pharmacyclics,并且艾伯维与强生共同分享Imbruvica®的收入。那么Imbruvica®是如何赢得420亿美元的估值呢?这其中可能有多个因素的影响:首先,依鲁替尼在FDA批准过程中就获得了突破性疗法认证、优先审评和加速批准三个特别通行证(FDA一共有四个药物审批加速通道),可知其潜力得到了FDA的认可。市场表现也印证了依鲁替尼的潜力,2015年,Imbruvica®的销售额已达14.4亿美元,正式跨入了重磅药俱乐部。其次,Pharmacyclics在2014年的公开资料中就曾披露,他们十分看重药品的知识产权保护,就依鲁替尼而言,核心专利的保护期预计到2026年12月,并有潜力延长至2027年11月。此外,Pharmacyclics针对药物的晶型以及不同类型癌症的治疗方法都申请了相应的专利进行保护。对于医药领域的发明,巧妙的专利布局有利于保持市场竞争优势,这也是Pharmacyclics能够被高价收购的重要原因之一。企业进行专利布局的重要原因是为了阻止竞争对手的攻势,从而持续获取利益。那么,什么样的专利策略能够更好地发挥知识产权的保护作用呢?我们且看Pharmacyclics围绕Imbruvica®这个产品进行的专利布局。
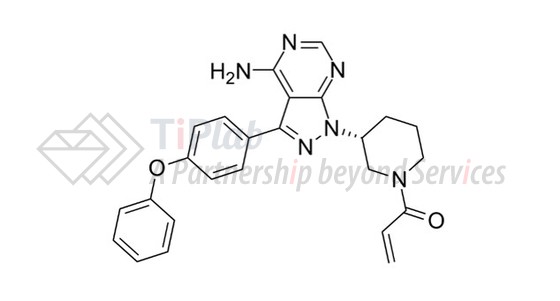
围绕重磅药物进行的专利布局
2006年12月,Pharmacyclics提交了第一个保护依鲁替尼的核心专利申请,并随后获得授权(US7514444)。该专利保护BTK抑制剂(依鲁替尼)化合物的通式、药学可接受的盐及其药物组合物。之后,Pharmacyclics陆续递交了US7514444的多个分案申请(Divisional application)和延续申请(Continuation application),这些专利申请分别请求保护该化合物的结构式、药物组合物(化合物+载体)、口服制剂、制备方法和治疗方法。仔细分析后不难发现,Pharmacyclics通过其专利组合获得的保护是强有力的。且不说针对化合物各种衍生物的保护,针对适应症的保护更是涵盖了所有的淋巴瘤。可见,Pharmacyclics在对核心化合物进行专利保护后,并没有停下脚步,而是伴随着对药品的持续研发不断对新的发现和改进进行后续保护,从而为那些后来者设置重重障碍。涉及依鲁替尼及其衍生物的大部分专利都将在2026年12月28日到期。
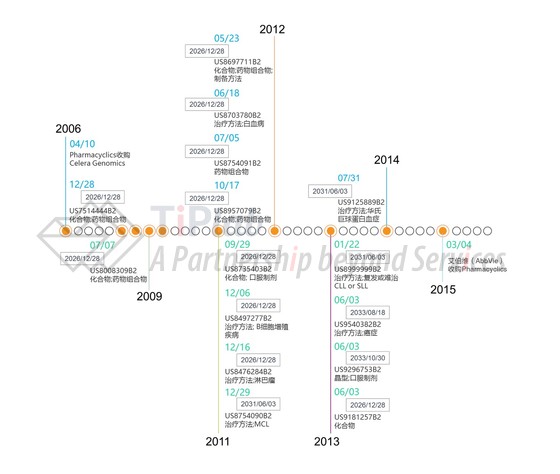
紧接着Pharmacyclics递交了针对套细胞淋巴瘤(MCL)治疗方法的专利申请并获得了授权(US8754090),该专利保护的是依鲁替尼用来治疗至少接受过一种疗法的MCL,限定给药剂量和方式为口服每天420 mg至840 mg之间,推荐每天560 mg。US8754090专利只有两个权利要求,并且保护范围比较窄,可谓是为日后产品上市打造的一只“精准型”专利。该专利后来受到了Kyle Bass提出的双方复审程序(Inter Parties Review,IPR)的挑战。Kyle Bass擅长通过IPR程序来无效制药公司的专利,并因此饱受争议。Bass对US8754090专利提出无效是因为该专利将依鲁替尼的专利保护期延长至2031年6月3号。Bass声称该专利是显而易见的,因为NCT00849654中已经披露了US8754090专利中保护的内容。不过专利审判及上诉委员会(Patent Trial and Appeal Board,PTAB)认为NCT00849654不满足成为“现有技术”的法律要求,并据此拒绝了Bass的IPR请求。同US8754090专利保护类型相似的专利包括US8999999和US9125889,分别针对特定适应症复发或难治性慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)和华氏巨球蛋白血症(WM),同样是保护范围比较窄的精准型专利,专利保护期限均至2031年6月3日。
随后,Pharmacyclics又递交了专利申请,请求保护依鲁替尼的晶型及其口服制剂(US9296753),这些专利将Imbruvica®的专利保护期延长至2033年。此外,Pharmacyclics还提交了针对治疗方法的专利申请PCT/US2013/043888,该申请随后进入美国国家阶段并被授予专利权(US9540382B2),该专利保护了使用依鲁替尼制剂治疗哺乳动物癌症的方法,将依鲁替尼的适应症范围从淋巴瘤扩展至实体瘤,并限定了给药剂量范围。该专利带来的益处不止于此,它也潜在地将Imbruvica®的专利保护期延长至2033年8月18日。
Pharmacyclics申请的专利或宽泛或精准,并通过持续的用途专利和晶型专利等将Imbruvica®的“法定垄断”期限从2026年延长至2033年。此外,依鲁替尼至今被FDA批准的适应症都获得了孤儿药的市场独占期。在美国,孤儿药被定义为治疗患者人数少于20万的药品,或者患者人数超过20万但销售额不能收回开发和流通成本的药品。《孤儿药品法》(Orphan Drug Act)规定孤儿药被FDA批准上市后将获得7年市场独占期(针对该药用于治疗该适应症),该保护是独立于专利保护的另一种市场独占保护,相应地,Imbruvica®针对部分适应症的市场独占期有望延长至2024年1月18日。
国内BTK抑制剂新秀—BGB-3111
在中国目前在研的BTK抑制剂品种中,BGB-3111可谓是一枝独秀。BGB-3111是百济神州的一款在研产品,能够特异性抑制BTK,而对EGFR、ITK、JAK3、HER2和TEC等其它蛋白激酶的抑制较少。2017年3月1日,百济神州宣布在中国启动BGB-3111针对复发或难治性套细胞淋巴瘤(MCL)的首个关键性临床研究。目前进行的还有一项BGB-3111针对华氏巨球蛋白血症(WM)与依鲁替尼比较的全球III期临床研究。另外,BGB-3111与BGB-A317(PD-1抗体)治疗多种B细胞恶性肿瘤的临床I期联合用药实验也已启动。此外,BGB-3111已获得了FDA的3项孤儿药资格认定。先前公布的BGB-3111单一药物治疗多种晚期B细胞恶性肿瘤的I期研究初步结果显示,BGB-3111对慢性淋巴细胞白血病和套细胞淋巴瘤的应答率均高于依鲁替尼。目前的临床数据还显示,BGB-3111可实现对血液及淋巴结中靶点的24小时持续抑制。那么这支新秀的专利布局又如何呢?
我们的研究显示,百济神州对于BGB-3111的核心专利申请始于2014年4月提交的国际申请PCT/CN2014/075943,该申请目前已在欧洲获得授权(EP2989106B1),相应的中国申请于2017年3月刚刚获得授权通知书(公开号CN104884458A)。在美国,该申请先通过PCT申请进入美国国家阶段的旁路途径(bypass)申请了PCT专利(PCT/CN2014/075943),接着又陆续提出了PCT/CN2014/075943的延续申请并已获得授权(US9447106B2和US9556188B2)。所谓旁路途径是将PCT申请作为母案在美国提出延续申请或部分延续(Continuation-in-part,CIP)申请。相比于常规的国家阶段途径,旁路途径的优势包括其作为美国的新申请可以不必严格对应PCT国际公布文本,并且能够利用CIP加入新的内容。此外,通过旁路途径提交的专利申请还可以通过优先审查(Track One)或普通加快审查(Accelerated Examination,AE)途径来加快专利的审查周期,而常规的国家化途径则不能利用这两种加快审查程序(但是有其他加快审查的可能性,比如PPH途径)。因此,PCT申请旁路途径在一些情况下可以作为PCT申请进入美国国家阶段的更好选择。PCT/CN2014/075943专利家族的内容涵盖化合物、药物组合物、对应的治疗方法(BTK活性相关的疾病)以及组合疗法。此外,百济神州还于2014年6月针对化合物以及使用化合物的前药或其氮氧化物治疗疾病的方法单独提交了美国专利申请(US20150005277A1)。
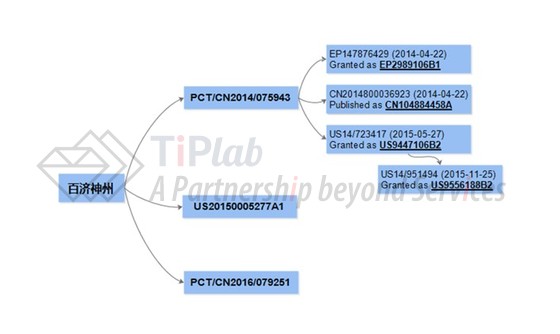
百济神州另一个专利家族源于2016年4月14日递交的国际申请PCT/CN2016/079251,该专利族尚未进入国家阶段。从国际申请阶段公开的文本来看,相比于上一族专利,该专利族限制了特定类型的化合物盐类,增加了化合物的制备方法并拓展了适应症范围。
可以看到,百济神州也针对其产品进行了较全面的专利保护,并在全球多个国家和地区进行了策略性布局,可见其研发伊始就对BGB-3111的未来充满了信心。就目前的临床实验结果来看,BGB-3111的表现相当令人期待。究竟这个BTK抑制剂界的后起之秀是否能超越传奇,再造辉煌并造福更多患者呢?让我们拭目以待。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
