Talzenna获批
Talazoparib(代号:BMN-673)是一种口服的PARP(Poly (ADP-ribose) polymerase)抑制剂,可有效抑制PARP酶并捕获DNA上的PARP。
PARP全称为多聚腺苷二磷酸核糖聚合酶,参与DNA断链修复。正常细胞内存在多种DNA损伤修复机制,单纯抑制PARP对正常细胞的毒性不会太大,但是对于某些肿瘤细胞,由于特定基因突变(比如BRCA突变)会破坏其他DNA修复通路,从而会对PARP抑制剂格外敏感。
BRCA1和BRCA2突变约占遗传性乳腺癌的25%至30%,当遗传性BRCA突变乳腺癌患者的疾病发展到晚期,治疗选择就会非常有限。
Talazoparib通过靶向与BRCA突变相关的缺陷DNA损伤修复过程来治疗乳腺癌,是辉瑞使用精准医学方法进行药物研发的成功案例之一。
在一项开放随机的EMBRACA的III期临床试验结果中,共纳入431例携带遗传性BRCA1/2突变的乳腺癌患者,与接受化疗的患者相比,接受talazoparib治疗的患者的无进展生存期(PFS)显著延长(分别为5.6个月和8.6个月),疾病进展风险降低了46%,而且talazoparib组的客观缓解率为62.6%,是化疗组(27.2%)的两倍以上。
基于该项临床试验,talazoparib获得了FDA颁发的优先审评资格,并于2018年10月获得了FDA的批准用于治疗gBRCA突变的HER2-阴性转移性乳腺癌,成为继olaparib之后FDA批准的第二个用于gBRCA突变型乳腺癌的PARP抑制剂。
Talzenna活性成分
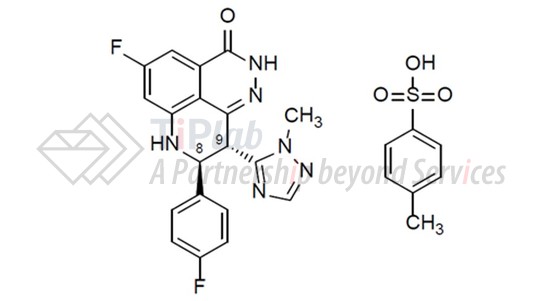
Talzenna®胶囊由talazoparib对甲苯磺酸盐(talazoparib tosylate)配制而成。Talazoparib tosylate的分子式为C26H22F2N6O4S,分子量为552.56 Dalton。化学结构如下:
Talzenna制剂
FDA批准的Talzenna®制剂包含0.25 mg和1 mg两种规格的胶囊,推荐剂量为1 mg/天,口服一次,饭前饭后均可。0.25 mg规格可用于剂量减少。
每粒胶囊含0.25 mg或1mg的talazoparib (分别为0.363 mg和1.453 mg的talazoparib tosylate)。
围绕Talzenna的专利申请
Talazoparib最初由LEAD Therapeutics研发,2010年LEAD Therapeutics被BioMarin收购,2015年Medivation从BioMarin获得该药的所有研发及商业化权利,后辉瑞通过收购Medivation获得了talazoparib。
活性成分专利家族
LEAD Therapeutics递交的专利申请
2009年,LEAD Therapeutics于同一天递交了涉及talazoparib活性成分的PCT专利(PCT/US2009/051879)和美国专利申请(授权公告号:US8012976B2),要求了三个美国临时申请的优先权,PCT/US2009/051879进入了包括US、EP、JP、CN等多个国家或地区。
US8012976B2的权利要求1涉及一种结构如下的化合物或其药学上可接受的盐:
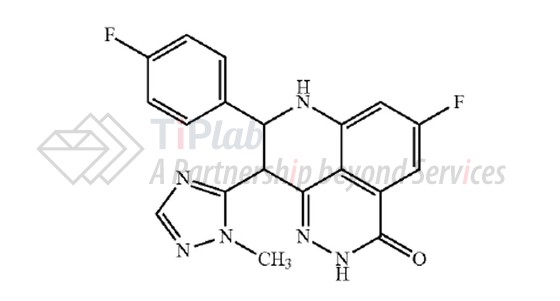
US8012976B2的权利要求1没有限定化合物的旋光性,涵盖talazoparib,权利要求2涉及包含talazoparib的药物组合物,权利要求3和4分别涉及具有旋光性的化合物。
US8012976B2专利保护期将至2029年10月。
BioMarin递交的延续案
以US8012976B2为母案,BioMarin递交了多个延续申请或分案申请,涉及活性成分或治疗方法,比如:
延续案US8420650B2则涉及一种通式化合物,限定范围不同于母案US8012976B2。
Medivation递交的分案申请
Medivation于2015年递交的分案申请(授权公告号:US9820985B2)涉及一种治疗乳腺癌的方法:授权的独立权利要求1涉及使用治疗有效量的talazoparib或其药学可接受的盐或其溶剂化物给予相关受试者,而独立权利要求5则涉及使用治疗有效量的化合物治疗乳腺癌,仅限定了相关化合物的通式。
上述提到的活性成分专利家族成员预计都将于2029年下半年到期。这三个不同的专利各自涵盖不同的范围,比如:母案涉及US8012976B2具体的化合物,延续案US8420650B2涉及一种通式化合物,分案US9820985B2则涉及相关化合物治疗乳腺癌的用途。
化合物晶型专利家族
Medivation还研究了化合物的相关晶型,并申请了晶型专利家族以保护其即将上市的产品。
对于原研企业而言,药物晶型专利保护可以延长基础专利的保护期,获得更长时间的垄断,同时对仿制药企业形成专利壁垒。
BioMarin于2011年的同一天递交了涉及化合物晶型的PCT国际申请(PCT/US2011/057039)。和美国专利申请(授权公告号为US8735392B2)。
US8735392B2的权利要求1涉及talazoparib对苯甲磺酸盐的晶型,并使用不同的理化性质对所述晶型进行了限定,具体为,限定晶型满足选自NMR、DSC、TGA和XRPD等表征参数中的至少一种特征,意味着talazoparib对苯甲磺酸盐结晶只要具有其中一种理化性质就落在了其保护范围之内。

PCT/US2011/057039进入中国国家阶段的授权专利为CN103282365B,涉及talazoparib对苯甲磺酸盐结晶,权利要求1中限定了晶型的X射线粉末衍射图案的一些特征峰。相对于同族的美国专利,CN103282365B的授权范围更小些。

在中国的专利审查和司法实践中,XRD或XRPD(X射线衍射图)是唯一能单独用于表征晶型的参数,DSC、IR等其它参数只能作为晶型鉴定中的辅助手段。
FDA批准的Talzenna®制剂为包含talazoparib tosylate的胶囊剂,PCT/US2011/057039晶型专利家族将Talzenna®的保护期延长至2031年10月 。
专利组合助力其赢得市场份额
我们梳理下talazoparib的研发历史:
LEAD Therapeutics最早开发Talazoparib,并申请了活性成分专利家族;
而后BioMarin收购LEAD Therapeutics,并申请了药物晶型专利家族;
最后辉瑞通过收购获得了talazoparib,并持续对这两个专利家族进行拓展.
可见参与talazoparib不同开发阶段的申请人共同构筑了围绕talazoparib的专利资产,这些专利资产分别在不同的时间段内圈定了不同的权利范围,可以起到制衡竞争对手的作用。
此外,辉瑞公司正在进行Talzenna®在其它癌症治疗中的研究,比如:和Array Biophamar的MEK抑制剂联用治疗非小细胞肺癌(NSCLC);在卵巢癌中的治疗用途等。同时,Talzenna®治疗前列腺癌已经处于3期临床试验中。可以预见,未来辉瑞将会有更多针对Talzenna®新用途的专利家族,为其占领更多的市场份额提供筹码。
目前在PARP抑制剂领域,另外还有Olaparib、Rucaparib和Niraparib已经上市,全球还有数十个PARP抑制剂处于临床研究阶段,竞争可谓激烈,玩家们纷纷对其产品构筑了专利组合,这些专利组合各具特点,影响着PARP抑制剂的竞争格局。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
