Siponimod vs gilenya
2019年3月26日,诺华的siponimod(商品名Mayzent®)通过美国食品药品监督管理局(FDA)审批,用于治疗成人复发型多发性硬化(MS),包括活动性继发进展型多发性硬化(SPMS)、复发缓解型多发性硬化(RRMS)和临床孤立综合征(CIS)。
Siponimod是诺华多发性硬化症药物gilenya的升级版本,两者都是鞘氨醇1-磷酸受体(S1PR)调节剂。
Gilenya于2010年获批上市,是全球销售额超过30亿美元的重磅产品。虽然诺华已成功延长gilenya美国市场的专利保护期,在全球范围内仍面临着仿制药竞争的威胁。2018年11月,FDA还对gilenya发出安全性警告,称停药后可能会导致MS病情恶化。
Gilenya与鞘氨醇1-磷酸受体S1PR1、S1PR3、S1PR4和S1PR5具有高结合亲和力,在激动S1PR1的同时也可激动S1PR3,引起心肌传导G蛋白的门控内向整流钾通道激活,从而导致临床出现心动过缓、房室传导阻滞等不良反应。
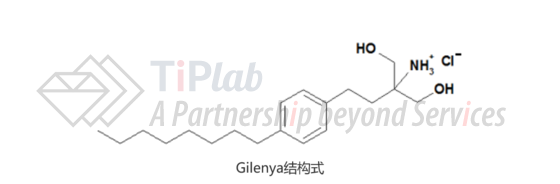
Gilenya不高的S1P受体选择性在一定程度上限制了其应用。于是,siponimod应运而生。
作为新一代选择性S1P受体调节剂,siponimod比gilenya具有较高的选择性,能够选择性结合免疫细胞的S1PR1,令受体失敏,并阻断免疫细胞进入中枢系统,因此具有抗炎作用。
值得一提的是,siponimod是目前首个也是唯一一个被证明能延缓SPMS疾病恶化的口服药物,并且正在接受欧洲药品管理局(EMA)和中国药品监督管理局(NMPA)的审批。

Gilenya通过化学修饰得到siponimod
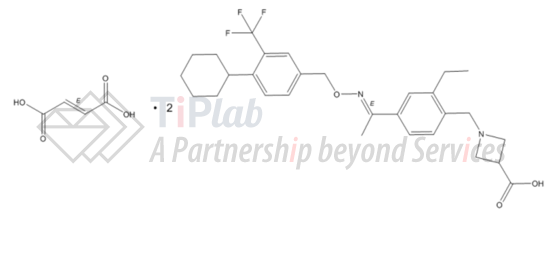
Siponimod是gilenya疏水侧链结构修饰得到的合成衍生物,其药用形式为siponimod化合物与富马酸2:1的共结晶,分子式为C4H4O4. 2C29H35F3N2O3,结构式如下:
Mayzent®的药品label中指出,为了减少对心脏的影响,建议患者在施用siponimod的初始阶段采用剂量滴定(dose titration),并逐步上调以达到维持剂量,即,治疗初始从0.25mg开始给药,在4-5天内逐步增加剂量以达到1mg或2mg的维持剂量。
为满足不同阶段的给药剂量需求,还提供了0.25mg和2mg两种规格的包衣片剂。
诺华如何构筑对新一代产品siponimod的专利保护
药物研发者通过提高siponimod的受体选择性和给药方案优化两种方式克服上一代产品的不足之处,并递交了一系列专利申请对技术方案进行保护,以涵盖已经获批的label中的技术方案。
活性成分专利家族
关于siponimod活性成分的专利申请,最初在2004年由IRM公司提出,包括PCT国际申请PCT/US2004/015603和美国申请US10/849323。
PCT/US2004/015603进入中国国家阶段的授权专利为CN1791395B,涉及式Ia的通式化合物或其可药用的盐或异构体,涵盖siponimod活性成分:
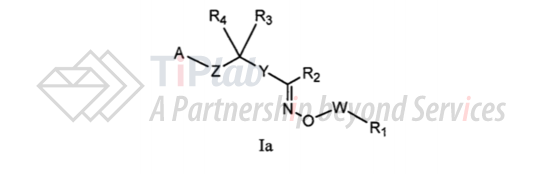
根据说明书的记载,实施例3的化合物(即siponimod)能够选择性结合S1P1受体,结合活性至少是与其他S1P受体(如S1PR2、S1PR3、S1PR4和S1PR5)的结合活性的1000倍。
同族的美国申请US10/849323处于失效状态。
以US10/849323为母案,诺华在2008年2月1日递交了延续案申请US12/024992,授权专利为US7939519B2,独立权利要求1涉及siponimod化合物,及其药学上可接受的盐、前药、立体异构体。
相较于gilenya,siponimod尤其对S1P1受体具有较高的选择性,由于对S1PR3的激活作用较弱,因此引起的心脏不良反应较小。
给药方案专利家族
除了活性成分本身的S1P受体选择性增加,药物研发者还通过建立特定的给药方案以降低药物的不良反应。
2009年12月21日,诺华递交了涉及siponimod给药方案的美国专利申请US12/655049,授权专利为US8492441B2,其涉及包含S1P受体激动剂的药物的给药方案,所述药物在起始阶段以低于其标准每日剂量的剂量给药,然后逐渐增加给药剂量,直到达到标准每日剂量。

在US8492441B2的权利要求1中并没有限制所述S1P受体激动剂的具体类型,有效阻止了竞争对手对相同给药方式的应用。从属权利要求4中则限定该S1P受体激动剂为包含siponimod在内的通式化合物。
同样涉及给药方案的还有与US8492441B2同时递交的国际申请PCT/EP2009/067618,其进入中国国家阶段的专利申请CN200980151942.7,被驳回失效。但是CN200980151942.7的分案申请CN201510541635.7,目前仍在审查中。与同族的美国专利相比,其权利要求1仅涉及siponimod活性成分的给药方案,权利要求1如下:
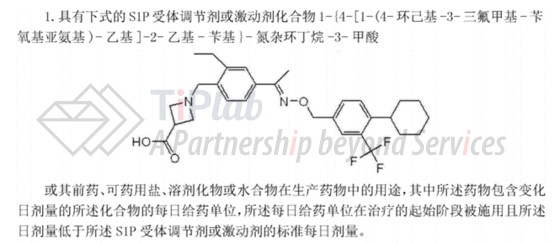
根据说明书中的记载,向受试者以剂量递增的方式施用化合物A(即siponimod),即,从0.25mg开始到10mg最大治疗剂量结束,相比于一开始就施用10mg剂量的组,这种计量滴定的方案虽然不能完全克服在起始阶段可能导致的心率短暂下降,但是在一定程度上减弱了患者服用S1P受体激动剂引起的负性频率(即,心率降低)作用,降低了心脏停搏次数。
这些给药方案专利涉及到的技术方案也基本上都紧紧围绕着siponimod的label展开,对上市的药物进行了有利的保护,有效延长了专利保护时间。
晶型专利家族
2009年12月16日,诺华递交了siponimod化合物晶型专利申请PCT/US2009/068143。该PCT申请进入了US、CN、JP、EP、等多个国家和地区,而进入US和CN国家阶段的原申请均处于失效状态,在此基础上,衍生出多个分案或延续案,总结如下:

其中,中国分案申请CN201510102280.1和美国延续案申请US15/799235目前在审查中。
CN201510102280.1的独立权利要求1涉及siponimod的半富马酸盐,从属权利要求则通过X射线粉末衍射图谱和FT-拉曼光谱限定了A、B、C、D、和E五种结晶形式。
而US15/799235的4项独立权利要求分别涉及siponimod半富马酸盐的结晶形式A、B、C和D,这些不同结晶形式的公开使得竞争对手在申请专利时会遇到新颖性的问题,若获得授权竞争对手则会面临更多的障碍。
Siponimod的半富马酸盐结晶对应药品label中化合物与富马酸2:1的共结晶,这些专利的技术方案也体现在药品label中。
专利申请为产品更新换代保驾护航
可见,药物研发者为了改善上一代产品性能,不断地优化技术方案,并适时申请专利,为计划上市的产品构筑强有力的保护网络,有效阻止竞争对手,从而延续原有的技术优势。这样,从“人无我有”转向“人有我优”,始终占据市场主导地位,带来商业价值的最大化。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
