个体化治疗的新里程碑—Xalkori
Xalkori® (crizotinib)是辉瑞公司开发的一款抗癌药物,用于治疗淋巴瘤激酶 (Anaplastic lymphoma kinase, ALK)或ROS1阳性的转移性非小细胞肺癌 (NSCLC)。
Crizotinib是一种酪氨酸激酶受体抑制剂,这些受体包括ALK、干细胞生长因子受体 (HGFR, c-Met)、ROS1 (c-cos)和 RON。易位会影响ALK基因,引起致癌融合蛋白的表达。致癌融合蛋白的形成又会引起基因表达及基因信号的激活和失调,进而促使表达这些蛋白的肿瘤细胞增殖和存活。
Crizotinib在肿瘤细胞株中对ALK、ROS1和c-Met在细胞水平检测的磷酸化有浓度依赖性抑制作用。对于表达EML4-ALK或NPM-ALK融合蛋白或c-Met的异种移植荷瘤小鼠表现出抗肿瘤活性。
在两项crizotinib治疗局部晚期或转移的ALK-阳性NSCLC患者的临床试验数据中,crizotinib在特定的非小细胞肺癌人群中取得了显著的客观缓解率。
其中,在PROFILE 1005 (n=136)中,ORR (客观缓解率)为50 %,中位治疗时间为22周。在治疗前八周,获得79 %的客观反应率;在试验1001 (n=119)中,ORR为61 %,中位治疗时间为32周。在治疗前八周,获得55%的客观反应率。
基于这两项临床试验,FDA于2011年8月批准Xalkori®用于局部晚期或转移的ALK阳性非小细胞肺癌 (NSCLC)。在此之前的6年间,FDA尚未批准过治疗肺癌的新药,Xalkori®证明了分子标志物检测在非小细胞肺癌中的重要性,成为个体化治疗药物研发的新里程碑。
2016年3月,FDA又批准Xalkori®用于治疗ROS1 (C-ros oncogene 1)阳性的NSCLC。2012年10月,欧洲药品管理局批准Xalkori®用于治疗间变性ALK阳性的非小细胞肺癌。
受到同类药品竞争的影响,2018年,Xalkori®的年销售额为5.24亿美元,与2017年的5.94亿美元相比,销量有所下降,但Xalkori®却代表了非小细胞肺癌 (NSCLC)治疗模式转变—从千篇一律的治疗方案转向通过生物标记物决策的治疗模式。

Xalkori活性成分
Xalkori® (crizonib)是一种口服的酪氨酸激素酶受体抑制剂,其化学式为C21H22Cl2FN5O,分子量为450.34 g/mol,其化学结构为:
Xalkori制剂
FDA批准的Xalkori®制剂为胶囊。
每粒胶囊含250 mg或200 mg的crizotinib,辅料包含:二氧化硅胶体、纤维素微晶、无水磷酸二氢钙、淀粉乙醇酸钠、硬脂酸镁和硬明胶胶囊壳等。
围绕Xalkori的专利申请
化合物专利家族
PCT/US2004/005495专利家族
Crizotinib最初由Sugen开发 (被Pharmacia收购,后者又被辉瑞公司收购)。2004年,Sugen于同一天同时递交了涉及活性成分的美国专利申请 (授权公告号:US7230098B2)和PCT专利申请 (申请号:PCT/US2004/005495)。
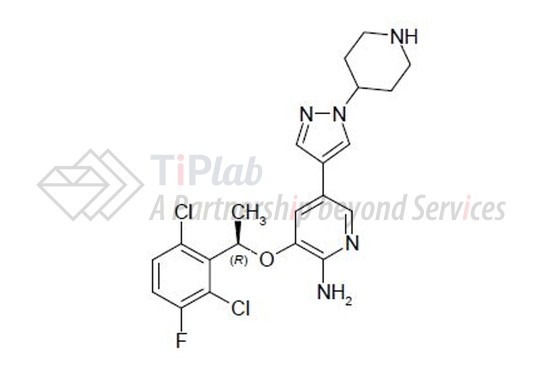
其中,US7230098B2的权利要求1中限定化合物通式为:
并限定了多个取代基,保护范围涵盖crizotinib,该专利保护期将于2025年底到期。
2006年,辉瑞公司递交了US7230098B2的分案并获得了授权(US8106197B2),涵盖更多的衍生物。该专利保护期将于2027年底到期。
PCT/US2004/005495进入中国国家阶段的授权专利为CN103265477B。
PCT/IB2005/002837专利家族
除了PCT/US2004/005495专利家族外,2005年,辉瑞以相同的优先权分别递交了美国专利申请 (授权公告号:US7858643B2)和PCT专利申请 (PCT/IB2005/002837)。
US7858643B2涉及包含crizotinib的化合物及其药物组合物。US7858643B2的专利保护期将至2029年12月。
PCT专利申请进入了多个国家或地域,其中进入中国国家阶段的授权专利为CN101023064B。
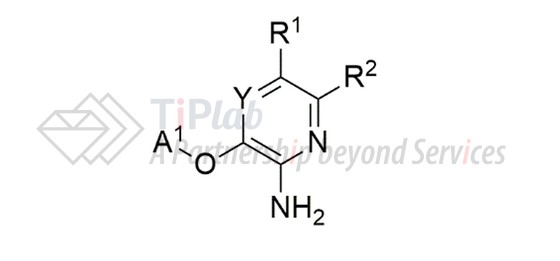
US7858643B2的延续案US8785632B2涉及另一类化合物:
限定范围不同于US7858643B2,进一步扩大了这类化合物的专利保护范围。
晶型专利家族
晶型专利是继活性成分专利之后的重要专利家族,可以进一步延长药品的生命周期。
在化合物核心专利家族之后,辉瑞于2006年递交了涉及化合物晶型的PCT专利PCT/IB2006/003383。
PCT/IB2006/003383进入美国国家阶段的授权专利US8217057B2涉及化合物crizotinib的晶型,以及包含该晶型的药物组合物。
其中,权利要求1保护:
“A crystalline form of free base of (R)-3-1- (2,6-dichloro 3-fluoro-phenyl)ethoxy-5-(1-piperidin-4-yl-1H-pyrazol-4-yl)-pyridin-2-ylamine having a powder X-ray diffraction pat tern substantially the same as shown in FIG. 1.”
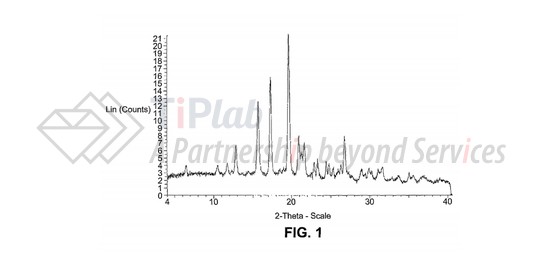
为了支持该权利要求的范围,辉瑞在实施例中主要提供了X-射线粉末衍射表征数据和差示扫描量热表征数据。
X-射线 (粉末)衍射对晶体结构表征具有“指纹性”,是验证化合物晶型最准确的表征手段。因此,在US8217057B2的实施例中,辉瑞公司对crizotinib的晶型进行了详细的X-射线粉末衍射表征,以支持权利要求中对该晶型的保护。
在X-射线衍射图中,出峰位置是区分不同晶型的重要参数,在从属权利要求中,辉瑞进一步对crizotinib的出峰位置进行了限定。
此外,独立权利要求6和7还分别涉及包含权利要求1中限定的crizotinib晶型的药物组合物和胶囊。
算上专利期调整,US8217057B2将Xalkori®的保护期限延长至2029年11月。
PCT/IB2006/003383进入中国国家阶段的授权专利CN101326175B同样涉及crizotinib的晶型、药物组合物及其胶囊剂。
治疗用途专利家族
之后,辉瑞于2006年11月递交了涉及治疗用途的PCT专利申请PCT/IB2006/003397,不断构建起围绕crizotinib的专利壁垒。
PCT/IB2006/003397进入美国国家阶段的授权专利US7825137B2涉及使用治疗有效量的crizotinib或其盐来逆转或抑制哺乳动物异常细胞生长进展的方法,并限定异常细胞生长是由ALK介导的癌症。
作为一种个体化治疗方法,crizotinib在给药前需要对ALK的表达水平进行检测。
因此,US7825137B2对癌症的限定方式并不是传统的部位限定方式,而是限定异常细胞生长是由ALK介导的癌症。
化合物的专利保护策略
结合Xalkori®的例子不难看出,不同于抗体等大分子药物,围绕小分子化合物的核心专利通常以结构通式来进行限定,而大分子药物则主要以序列和功能进行限定。
此外,晶型专利是继化合物核心专利家族之后的重要家族,是继化合物专利家族后阻止仿制药上市进程的利器。
除了我们提到的化合物专利、晶型专利和治疗用途专利,常见的保护化合物的专利类型还包括制剂、制备方法、新适应症专利等,将这些专利结合起来以尽量延长产品的生命周期。
