乳腺癌治疗的里程碑式突破—赫赛汀®
20世纪末,HER2阳性乳腺癌患者通常采用化疗方法进行治疗,而部分患者对传统的化疗方法并不敏感,这成为阻碍HER2阳性乳腺癌患者长期生存的主要原因。 1998年,全球首个HER2阳性乳腺癌生物靶向药物—赫赛汀®的问世,彻底扭转了这一局面,从而显著提高了HER2阳性乳腺癌患者的生存率。我们先通过下面的小档案认识下今天的主角—赫赛汀®:

曲妥珠单抗的诞生可以称之为一个奇迹,为此还有一部影片《Living Proof》专门讲述曲妥珠单抗诞生背后的故事。曲妥珠单抗曾一度被Genentech(2009年被罗氏收购)嫌弃,但凭借着科学家们的执着,最终成为了一款明星药物。与其它的重磅药相比,虽然赫赛汀®在适应症的种类上是逊色了些,但显著的治疗效果和广大的患者数量使得赫赛汀®早已成为重磅药,并在2012年还突破了60亿美元的销售额,此后的年销售额也一直处于60亿美元以上。
不过,对于20世纪末上市的重磅药们来说,这几年都经历着专利到期的窘境,赫赛汀®也不例外。赫赛汀®在美国的核心专利(US5821337A)已于2015年到期,接着仿制药企业们就立即开始行动,试图通过生物类似药申请(即351(k)申请)的途径获批。不过,对于一款重磅药来说,原研药公司当然为竞争对手们布下了重重的专利障碍。为了能够早日获批,于是仿制药公司们轮番去挑战保护曲妥珠单抗的其它重要专利,且听下面一一讲述。
Herceptin®在美国遭遇的专利挑战
来自Mylan的第一波挑战—达成和解
继核心专利到期后竞争对手面临的主要障碍可能是涉及到抗体的制备方法、制剂和治疗方法等专利。Mylan/Biocon是首个发起挑战的仿制药企业,并将第一个目标锁定为涉及制备人源化抗体的专利,于是向PTAB递交了两份IPR请求,试图去无效US6407213。
US6407213的权利要求1保护一种人源化抗体的可变结构域,包括非人源的CDR区和人源抗体可变区,其中FR区在特定位点进行了氨基酸取代。权利要求30保护能够结合p185HER2的抗体,包含人源化抗体可变结构域。相比于非人源抗体,人源化抗体的免疫原性更低,此外,FR区的氨基酸取代能够保持或提高非人源氨基酸残基的亲和力。US6407213的权利要求并没有限定具体的产品,是一个保护范围比较“宽泛”的专利,而罗氏曾公开表示,US6407213披露的人源化抗体正是涉及到赫赛汀®和其它几种产品的制备方法。可见US6407213是继核心专利后打击竞争对手的又一专利利器,将于2019年6月18日到期。
还没等PTAB作出最后的判决,双方先于2017年3月达成了和解,罗氏将为Mylan提供在全球销售赫赛汀®的许可,而PTAB随之宣布终止这两份IPR诉讼的审查程序。罗氏之所以会这么轻易的将销售权许可给了竞争对手,一方面是为了维持US6407213的有效性,另一方面是因为罗氏已经上市了新的改进产品—Kadcyla®(我们将在下文中介绍),以缓解核心专利到期的压力,可见罗氏早已为此做好了准备。
Mylan已于2016年11月向FDA提交了赫赛汀®的生物类似药上市申请。双方的和解也意味着Mylan将会抢占在美国销售赫赛汀®首仿药的市场先机。
来自Hospira的第二波挑战
除了与抗体制备相关的专利,涉及抗体纯化方法和治疗方法的专利也会成为原研药企阻碍生物类似药上市的重要手段。
其中,抗体的纯化方法会影响产品的质量和疗效,是抗体生产中十分重要的环节,因此原研药可能据此对竞争对手提起诉讼。于是Hospira(2015年被Pfizer收购)先入为主,首先于2016年9月通过IPR途径挑战保护抗体纯化方法的专利US7807799。US7807799保护包含CH2/CH3结构域的蛋白质的纯化方法,通过降低温度或加入蛋白酶抑制剂的方法减少蛋白质A在亲和层析过程中的浸出,在某些从权中限定了抗体为曲妥珠单抗。US7807799将于2024年6月24日到期,在到期之前接近7年的时间里,对竞争对手来说都是一个潜在的威胁。2017年3月,PTAB接受了其IPR请求并开始进行审查。
正如之前我们提到的,赫赛汀®获批的两个适应症都是HER2过表达的癌症,而罗氏获得的治疗方法/用途专利大都针对HER2阳性癌症的治疗方法。因此,竞争对手试图通过选择性逾越治疗方法/用途相关的专利障碍也变得十分困难,而不得不去挑战这些专利。
2017年1月,Hospira一口气递交了三份IPR请求,其中一份挑战US7846441,另两份挑战US7892549。US7846441保护使用联合疗法治疗ErbB2过表达癌症的方法,联合疗法包括结合ErbB2胞外结构域4D5表位的抗体+紫杉醇类化疗药。US7892549是US7846441的延续案,保护使用联合疗法治疗ErbB2过表达乳腺癌的方法,联合疗法包括结合ErbB2胞外结构域4D5表位的抗体+紫杉醇类化疗药+生长抑制剂。这两个专利涵盖了说明书中适应症和给药方法,都将于2018年12月10日到期。
目前,挑战US7846441的IPR请求已被PTAB拒绝,而挑战US7892549的两份IPR请求其中一份被PTAB拒绝,另一份PTAB作出了初步决定,认为权利要求1-17是显而易见的,但还未做出最终决定。虽然US7892549最终可能会被部分无效掉,但其母案US784644的存在意味着该障碍仍未被扫除。
Hospira紧接着于1月底又追加了两份IPR请求,分别挑战治疗方法/用途专利US6627196及其分案US7371379。其中,US6627196和US7371379的权利要求1都保护使用抗ErbB2抗体治疗ErbB2过表达癌症的方法,并限定了具体的给药剂量,具体为最初施用至少5 mg/kg的抗ErbB2抗体,后续每隔至少两周向患者施用等同或少于初始剂量的抗体。US7371379还包括向患者施用有效量的化疗剂。US6627196和US7371379的其它独权只限定了给药顺序,而没有限定具体的给药剂量。这两个专利的权利要求都保护了说明书中针对乳腺癌和胃癌的给药顺序和剂量。US6627196将于2020年8月25日到期,而US7371379有效期至2022年2月16日。不过,PTAB尚未接受这些IPR请求。
接下来换做Pfizer上场,首先于2017年6月递交了两份IPR请求,同样针对治疗方法/用途专利US8591897,US8591897保护治疗非转移性HER2阳性乳腺癌的辅助治疗方法,通过施用基于蒽环类/环磷酰胺(AC)的化疗剂,随后连续施用紫杉烷和曲妥珠单抗。对应说明书中乳腺癌的辅助治疗方法。PTAB目前还未接受这些请求,不过鉴于PTAB已经在Celltrion递交的IPR请求中无效掉了US8591897的部分权利要求,预计最终US8591897仍会被无效。
之前Mylan针对涉及制备人源化抗体的重要专利US6407213的挑战与罗氏达成了和解,但该专利仍难逃被挑战的命运。Pfizer于2017年5月递交了两份针对US6407213的IPR请求,而PTAB还未接受这些请求。
为了确保生物类似药的顺利上市,Hospira/Pfizer可以说是将所有保护赫赛汀®的重要专利都挑战了一遍,先是挑战一个纯化方法的专利,接着挑战了五个治疗方法/用途专利,还继续挑战了保护人源化抗体的专利。可见Hospira/Pfizer对其产品的获批上市还是很有信心的。
Hospira/Pfizer的赫赛汀®的生物类似药正处于临床Ⅲ期阶段,2016年11月公司公布了其生物类似药在HER2阳性转移性乳腺癌患者临床试验中的积极结果,不过还未披露是否向FDA递交了申请。
来自Celltrion的第三波挑战
Celltrion/Teva已于2017年8月向FDA递交了赫赛汀®的生物类似药上市申请。
在此之前,Celltrion于2017年2月递交了两份IPR请求,先于Pfizer挑战罗氏的治疗方法/用途专利US8591897。PTAB于同年9月无效掉了US8591897的权利要求1-13。
接着2017年3月,Celltrion继Hospira之后也递交了四份IPR请求,继续挑战罗氏的四个治疗方法/用途专利。分别针对US7846441、US7892549、US6627196和US7371379。PTAB尚未接受这四份IPR请求。
而US6407213也毫无意外地遭到了Celltrion的挑战,不过PTAB尚未接受。
我们尝试在下图中总结了保护Herceptin®的部分美国专利。

Herceptin®在中国的专利保护
Herceptin®早在2002年就进入了中国市场,我们来看下它在中国的专利保护情况。Genentech首先申请了一些保护重建制剂和蛋白质纯化方法的专利,比如CN1151842C保护一种等渗重建制剂,由蛋白质和稀释剂制成。曲妥珠单抗在使用前需要将冻干制剂配制为溶液以供静脉输注,CN1151842C正是用来保护这一重建制剂。不过该专利已经于2006年届满失效。CN1305896C保护使用阳离子交换色谱来纯化抗体的方法,将于2019年5月到期。
此外,Genentech还申请了一系列治疗用途相关的专利,比如:CN1269839C保护使用抗ErbB2抗体和化疗剂联合治疗ErbB2过表达疾病中的用途,将于2018年12月到期。CN101332300A保护抗ErbB2抗体在治疗ErbB2过表达疾病中的用途,并限定了给药剂量,不过该专利仍处于审查阶段。
Perjeta®和Kadcyla®的问世
赫赛汀®上市后多年临床应用的有效性再次证实HER2这个靶点的重要性,因此罗氏针对这个靶点又陆续研发了两个新的药物。并分别在赫赛汀®专利到期前获得了FDA的批准上市。
帕妥珠单抗(Pertuzumab,商品名Perjeta®)是一种重组人源化单抗,通过靶向HER2胞外二聚体结构域阻断HER2受体的二聚化而抑制其激活,帕妥珠单抗还可以介导ADCC效应。帕妥珠单抗的结合位点有别于曲妥珠单抗,于2012年6月首次获批上市,与曲妥珠单抗和多西他赛等联合用于治疗未接受过HER2治疗或化疗的HER2阳性转移性乳腺癌患者。
除了对不同抗体的开发之外,考虑到抗HER2抗体通常与化合物联用,于是罗氏的科学家们试图开发抗体药物偶联物(Antibody-drug conjugate,ADC),这样既可以降低化疗药的副作用,又可以达到比联合施用更好的效果。
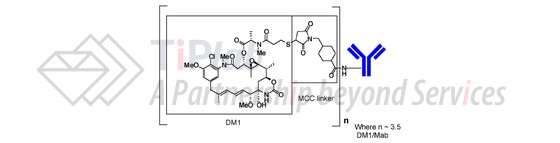
Ado-Trastuzumab Emtansine (简称T-DM1,商品名Kadcyla®)就是一种抗体药物偶联物,由曲妥珠单抗和美登素衍生物DM1共价连接而成。美登素衍生物DM1是一种微管抑制剂,能够诱导细胞凋亡。当曲妥珠单抗与细胞表面的HER2结合后,可以在细胞内释放DM1而发挥作用,从而降低DM1的全身毒性。为此,罗氏还针对T-DM1申请了专利并获得了授权(US7575748),US7575748保护肿瘤的治疗方法,包括:(1) 鉴定肿瘤以过表达ErbB2为特征并且对于抗ErbB抗体治疗反应不足;(2) 施用huMab 4D5-8(即曲妥珠单抗)与美登木素生物碱DM1的缀合物,给药剂量为0.2~10 mg/kg。
T-DM1于2013年2月首次获批上市,作为单一药物用于治疗已接受过曲妥珠单抗和紫杉烷分别或联合治疗的HER2阳性转移性乳腺癌患者。上市后仅仅四个月,就有8%的患者接受了Kadsyla®的治疗,而短短两年后的年销售额就已接近8亿美元,这预示着未来Kadsyla®将会取得不错的市场表现。
罗氏将继续保持市场竞争优势
虽然罗氏的赫赛汀®专利遭到了仿制药企的频频挑战,并且Mylan的仿制药可能将于1~2年内率先在美国上市销售。但凭借着Kadsyla®上市后的日益成功,将会弥补赫赛汀®生物仿制药上市对公司收入的影响,而罗氏也将继续保持在HER2阳性乳腺癌市场的竞争优势。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
