专利舞蹈是什么
根据 “生物制剂价格竞争与创新法案”(Biologics Price Competition and Innovation Act,简称BPCIA)的规定,生物类似药申请人(下文中统称为“仿制药企业”)在向美国FDA申请报批的过程中,需要通过一系列复杂的程序来跟原研药厂把相关专利问题交涉清楚(例如,生物类似药可能侵犯哪些专利,为什么侵权或者为什么不侵权),这个过程又被称作“专利舞蹈”,目的是在仿制药上市前就解决相关专利纠纷。“专利舞蹈”是一个非常费时、费力、费钱的漫长过程,会牵扯双方(特别是仿制药企业)大量的精力,因此可能大大减少有能力参与美国生物类似药游戏的竞争者数目。
专利舞蹈怎么跳
专利舞蹈的触发以及生物类似药信息的提供
一旦生物类似药申请人递交了生物类似药申请(351(k)申请),就触发了“专利舞蹈”程序。BPCIA要求仿制药企业在指定期限内将有关该生物类似药的信息提供给原研药厂家(reference product sponsor,下文统称为RPS) (42 USC 262(l)(2))。
这个指定期限是多久呢?答案是20天,从FDA接受生物类似药申请并开始审查之日起算。
那么仿制药企业需要将哪些信息提供给RPS呢?这主要包括两类,第一类是“应当(shall)”提供的,第二类是“可以(may)”提供的,分别简述如下:
1)第一类:应当提供的信息包括1)向FDA递交的申请材料的副本;以及2)描述该生物类似药生产方法/工艺(processes)的信息;
2)第二类:可以提供的信息包括RPS要求提供的其它信息。
那么这就涉及到一个问题,如果上面谈到的需要提供给RPS的信息涉及到仿制药企业的技术秘密和技术诀窍(know how)怎么办?42 USC 262(l)(1)(B)专门探讨了这个问题。其中规定,不是所有人都有资格看这些信息,只有某些符合要求的律师和授权代表有资格看。此外,看过这些信息的人有保密义务,而且这些信息只能用于判断生物类似药是否会侵权,不能用于其它目的。
虽然如此,通常仿制药企业在提供信息这件事上还是非常谨慎的。例如,某些临床前试验数据和临床试验数据通常与判断生物类似药的生产工艺是否侵权关系不大,那么仿制药企业可能选择不向RPS提供这部分数据。但是,这么做也是有风险的,例如RPS可能会据此立即将生物类似药申请人告上法庭(35 USC 271 (e)(2)(C)(ii),不提供相关材料将被认为构成侵权行为;以及42 USC 262(l)(9)(C)规定的情形),RPS还可能要求法院颁发临时禁令(preliminary injunction)。所以,仿制药企业需要仔细权衡是否提供相关材料以及到底提供哪些材料。
提供相关专利列表及双方各自陈述意见
仿制药企业提供了相关信息后,球就被踢到了RPS这一边。RPS需要在60天内提供生物类似药有可能侵权的专利列表(42 USC 262(l)(3)(A)(i) and (ii)),这些专利可能涉及:产品、制造方法或使用方法。此外,RPS还可以提供一个专利列表,列出其愿意许可给仿制药企业的那些专利。
然后,仿制药企业有60天时间准备答复意见,其中需要针对每个专利的每项权利要求逐条分析相关专利为什么无效、不能实施或者为什么其生物类似药不会侵犯相关专利权。或者,仿制药企业需要声明,相关专利在该生物类似药上市销售时将已经到期 (42 USC 262(l)(3)(B)(i),(ii)和 (iii))。
收到仿制药企业的答复意见后,RPS又有60天时间提供自己的分析意见,也需要针对每个专利的每项权利要求逐条分析,针锋相对地阐述为什么仿制药企业关于专利无效或者生物类似药不侵权的意见不成立 (42 USC 262(l)(3)(C))。
双方谈判及专利诉讼的启动
一旦仿制药企业收到了RPS的答复意见,双方就将进入谈判环节以确定到底用哪些专利来立即开始打官司(清单上的其它专利可能在将来被用来打官司)。这个回合的交手需要速战速决,因为法律规定谈判必须在15天内结束(42 USC 262(l)(4)(A)和(B))。谈判结束并不代表双方必须达成一致意见,而是可能有两种结果:1)双方达成一致意见;和2)双方无法达成一致意见。
如果双方就立即用于诉讼的专利达成一致意见,那么RPS将有30天的时间来提起专利诉讼(42 USC 262(l)(6)(A))。如果双方无法达成一致意见,那么在5天内,双方各提供一份用于立即开始诉讼的专利清单(42 USC 262(l)(5)(A)和(B))。此后,RPS有30天时间就这两份清单中的专利立即提起专利侵权诉讼。
仿制药企业一旦收到RPS起诉的诉状副本,就需要在30天内通知FDA相关专利诉讼这件事(42 USC 262(l)(6)(B)和(C))。如果双方在“专利舞蹈”过程中不立即进行任何专利诉讼,就需要考虑,一旦生物类似药获批上市,RPS可能会提起侵权诉讼并要求法院颁发禁令。跟这样的风险相比,仿制药企业还是应该力争在生物类似药正式销售之前把专利问题搞清楚,例如请法院就是否侵权给出明确意见。
我们尝试在下图中对专利舞蹈的过程进行了总结。
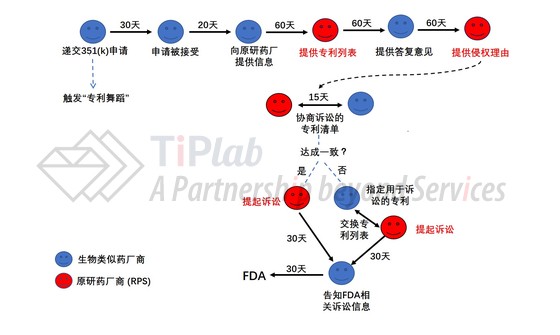
由以上过程可知,仿制药企业只有很短的时间就相关专利为何无效或者生物类似药为什么不侵权进行答复,因此,仿制药企业应当在递交351k申请之前就做好充分的准备。如何进行准备呢?例如,可以针对目标产品进行全面的自由实施分析(FTO分析),从而找出将来有可能被用于诉讼的相关专利,并针对这些专利的每一项权利要求逐条进行侵权风险和/或有效性分析。这样的工作可以为届时在60天或更短的时间内答复RPS奠定基础。要知道,仿制药企业如果希望自己的产品尽快获批上市销售,就需要尽量缩短而不是延长专利舞蹈的时间。相应地,就需要把准备工作做在前面。此外,还需要注意的是,在专利舞蹈的过程中,所解决的专利纠纷仅涉及RPS的相关专利,而不涉及到任何第三方,所以,即使专利舞蹈进行得很顺利,也不能排除生物类似药上市后因专利侵权而被起诉、甚至获得禁令的风险。只有提早进行全面的FTO分析才能把这些潜在的雷都尽早找到,并相应地进行准备。
Sandoz与Amgen的纠葛
在专利舞蹈这件事上,“第一个吃螃蟹”的人是Sandoz。
2014年7月的一天,Sandoz向美国FDA递交了史上第一个生物类似药申请(§351(k) ),申请号为BLA 103353,从而触发了史上第一次“专利舞蹈”。然而,这却是一次失败的舞蹈。
Sandoz的生物类似药所参照的品种为Amgen的重磅炸弹药物Neupogen,根据上面的介绍,Sandoz应该在其申请被FDA接受审评后的20天内开始进行专利舞蹈。但是,Sandoz决定不跳这支舞!具体而言,Sandoz拒绝在上述的20天内向Amgen提供BLA申请的副本及关于生物类似药生产方法/工艺的信息。这下,Amgen可急了,一下子将Sandoz告到了北加州地区法院,在诉状中指责Sandoz公然藐视BPCIA的规定,其拒跳专利舞蹈的行为违法,法院应当为此向Sandoz颁发禁令。于是,Sandoz跟Amgen之间争议的第一个焦点就是:仿制药企业如果拒绝参与“专利舞蹈”,RPS是否能据此请法院向仿制药企业颁发禁令。
除此之外,BPCIA还有一个要求,规定仿制药企业必须在对获批产品进行首次商业推广前至少180天,向RPS发出通知。接到仿制药企业的通知后,RPS可以寻求临时禁令,从而在法院对相关专利纠纷做出决定之前阻止仿制药企业生产或者销售该生物类似药 (42 USC §262(l)(8))。Sandoz与Amgen对这项规定该如何解释也有不同意见。Amgen认为这180天的起算日不可早于该生物类似药的获批日期,因为法律要求所涉及的产品必须为“获批产品”,而Sandoz认为,这180天可以从申请递交后的任何时间点起算,只要满足通知RPS后等待至少180天再进行商业推广的要求即可。因此,Sandoz跟Amgen之间争议的第二个焦点是:180天的通知“等待期”是否只能在生物类似药获批之后起算。
就这两个争议的焦点问题,双方各执一词,并且官司一路打到了美国最高法院。
对于争论的第一个问题,Amgen认为, 42 USC §262(l)(2)(A)明确要求仿制药企业提供相关信息,从而使得RPS能够判断FDA正在审评的生物类似药是否侵犯其专利权以及侵犯哪些专利权,Sandoz一面想享受BPCIA带来的快速审评、能够依赖RPS的在先试验数据等便利条件,一面又不想履行BPCIA赋予其的信息披露义务,这是不应当被允许的,而法院应当据此向不守规矩的仿制药企业颁发禁令。那厢,Sandoz认为,虽然42 USC §262(l)(2)(A)中在提到提供相关信息的要求时使用了“shall”这样的字眼,孤立看来似乎是强制性规定,但是不能因此而向选择不提供相关信息的仿制药企业颁发禁令。这是因为,对于仿制药企业不提供相关信息的后果,BPCIA中也有明确规定。例如,在42 USC §262(l)(9)(C)和35 USC §271(e)中就规定了,如果仿制药企业拒绝提供BLA申请的相关信息,RPS可以立即向法院提出侵权诉讼并且通过“发现”(discovery)程序获得相关信息。可见,BPCIA中明文规定的后果中并不包括向仿制药企业颁发禁令这样的惩罚措施。
关于这第一个争论的焦点,最高法院基本上认同Sandoz的观点,认为即使仿制药企业拒绝参与“专利舞蹈”,法院也不能据此向该仿制药企业颁发禁令,从而强迫其开始“专利舞蹈”。相反,当仿制药企业拒跳“专利舞蹈”时,应该按照42 USC §262(l)(9)(C)和35 USC §271(e)中的规定执行(例如,RPS可以立即向法院提出侵犯专利权的确认之诉)。此外,最高法院还认为,当仿制药企业拒跳“专利舞蹈”时,法院还应当考虑各个州的相关法律规定,从而判断这种行为是否会因为除BPCIA外的其他原因(例如,违反该州的不正当竞争法)而带来禁令。
对于争论的第二个问题,Amgen认为,42 USC §262(l)(8)中明确规定了是“licensed product”,意指生物仿制药获批后,180天才能起算。Sandoz强烈反对,认为这是对法条的曲解,如果按照这种解释方式,就相当于仿制药企业在生物类似药获批后,至少还得等半年才能开始销售,这无异于给RPS提供了专利权和市场独占权之外的额外6个月独占期,于法无据。
关于这第二个争论的焦点,最高法院也是站在Sandoz这一边,认为“licensed product”是限制“commercial marketing”的、而非限制“notice”的。换句话说,法律要求相关生物类似药在商业推广之时应该已经获批,并不要求在仿制药企业向RPS发送通知之时,该生物类似药已经获批。
对未来的影响
美国最高法院的这一判决将对专利舞蹈的规则、甚至未来美国生物类似药行业的发展产生重要影响。一方面,鉴于专利舞蹈要求仿制药企业向RPS提供完整的BLA信息及其它信息,其中可能涉及到技术秘密,而且整个专利舞蹈的过程非常费时费力,可能会有越来越多的仿制药企业选择拒跳“专利舞蹈”。无论是否拒跳专利舞蹈,专利侵权诉讼都基本上躲不掉。要想使生物类似药顺利上市销售(例如,不被禁售),就需要提早准备,全面了解围绕原研药的相关专利,确定哪些专利可以避开,对哪些专利需要采取无效等行动,提早收集证据,从而避免届时措手不及。否则,出局也只不过是早晚的事情。
另一方面,由于此次明确了仿制药企业无需等生物类似药获批后才能向RPS发送通知,继而启动180天的时限计算,因此,仿制药企业也就无需在生物类似药获批后再等180天才能开始销售,从而会加快生物类似药上市的速度。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
