PCSK9抑制剂evolocumab
人体血液循环中低密度脂蛋白胆固醇(LDL-C)通常被认为是“坏”胆固醇,其浓度的升高会增加动脉粥样硬化性心血管疾病(ASCVD)的发生风险,遗传性FH中也伴随着LDL-C含量的增加,因此降低血液循环中LDL-C的水平可以降低相关疾病的发生。
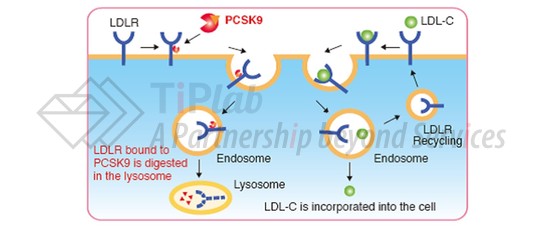
正常情况下,LDL-C主要通过与其受体LDL-R结合形成复合体进入肝脏细胞内被降解而从血液中清除。研究发现,PCSK9能够与LDL-R结合并使其降解,降低肝脏清除LDL-C的能力,因此抑制PCSK9可以下调血液中LDL-C的含量。
2015年8月27日,美国FDA批准Repatha®(活性成分evolocumab)用于杂合/纯合性FH的辅助治疗,或治疗需要额外降低LDL-C水平的ASCVD。
Evolocumab能够与血液循环中的PCSK9结合,阻止PCSK9介导LDL-R的降解,使LDL-R再循环回肝细胞表面继续发挥清除血液中LDL-C的作用。
Repatha®已在包括中国、美国及欧盟所有成员国等60多个国家和地区获批。2017年Repatha®的销售额为3.29亿美元,相较于2016年,其销售量增长了126%。
Amgen围绕evolocumab的全球专利申请
2008-2015年,围绕着evolocumab,Amgen在全球申请了多项专利,其内容覆盖结合PCSK9的抗原结合蛋白(如WO2009026558A1、US8030457B2)、胆固醇相关病症的治疗方法(如WO2012154999A1、US20130064825A1)、抗PCSK9抗体制剂(如WO2013166448A1、US20140030270A1)和结晶型抗PCSK9抗体(如WO2016010924A1)等。
涉及活性成分的专利申请
US8030457B2在2011年10月4日获得专利权,其权利要求1保护一种结合PCSK9的中和抗原结合蛋白,并对抗原结合蛋白的重链、轻链的CDR序列及其结合的PCSK9蛋白的序列进行了限定。
通过比对该抗原结合蛋白的重链和轻链的CDR序列,我们发现其分别对应evolocumab重链和轻链的一部分,保护范围涵盖evolocumab。在不考虑专利期延长的条件下,US8030457B2预计2029年5月到期。
以US8030457B2为基础上,Amgen通过部分延续案、延续案、分案申请等方式又递交了26件专利申请(10件还处于在审状态)。
其中获得授权的专利,如US8563698B2对结合PCSK9的抗体的靶标的序列和结合性质同时进行了限定,保护范围较宽泛。
US9045547B2保护了使用抗PCSK9单抗治疗高胆固醇血症的方法、US8829165B2保护了PCSK9单抗的结合位点。
涉及抗体制剂的专利申请
US20140030270A1的权利要求1请求保护一种包含结合PCSK9单抗的制剂,对制剂中抗体的浓度、相关辅料组成及浓度和制剂的pH等进行了限定,其同族的国际申请PCT/US2013/039561(国际公开号:WO2013166448A1),进入了中国和欧洲等国家和地区,目前该家族的专利均处于在审状态,尚未获得授权。
治疗用单抗药物往往需要满足100mg/mL以上的递送剂量,因此对高浓度的药物配方有较高要求。而由结晶蛋白制备的结晶制剂因含有高浓度的蛋白,在一定程度上可以解决这个问题。
2015年7月13日,Amgen递交了一项涉及“结晶型抗PCSK9抗体”的国际申请PCT/US2015/040211,其对应的美国专利申请US20170198058A1请求保护一种结晶型抗PCSK9,限定了抗体的重链和轻链的CDR序列及制备结晶型PCSK9抗体的方法,该专利尚未获得授权。
涉及治疗用途的专利申请
涉及“胆固醇相关病症的治疗或预防方法”的国际专利申请PCT/US2012/037394(国际公开号:WO2012154999A1)进入了中国、欧洲、日本、加拿大和韩国等国家,其中进入日本国家阶段的申请已经获得授权(JP6166717B2)。
Amgen在递交PCT申请的以相同的优先权同时递交了美国专利申请,(US20130064825A1),其权利要求40请求保护一种利用抗PCSK9抗体治疗或预防胆固醇相关病症的方法,该专利尚处于在审状态。
药物注射器专利
2016年7月,美国FDA批准了Repatha®的新的给药装置Pushtronex™。Pushtronex™预填充有evolocumab(规格为420 mg/3.5 mL),可单次提供420mg的注射剂量。当注射时,Pushtronex™可黏附于身体上,患者能够进行行走等适度的身体活动。 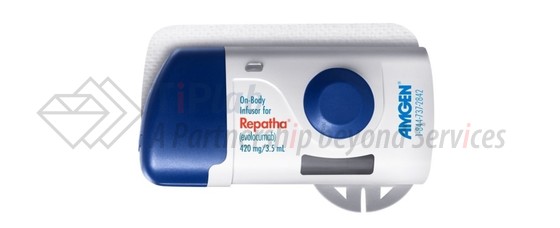
Amgen的预填注射器为患者提供了一种新的注射方式。2012年10月11日,Amgen递交了保护改良版注射器的国际专利申请PCT/US2012/059680,其进入中国国家阶段的专利申请于2016年12月14日获得专利权(CN103930142B)。
CN103930142B的权利要求1为:

CN103930142B的权利要求1保护一种包括具有壁的容器、密封组件及流体递送系统的注射器,致动器能够移动递送系统中的容器针使其穿过密封组件的内表面进入储存药物的无菌空间实现药物的递送。
CN103930142B的分案申请(公开号:CN106943645A)尚处于在审状态,还未获得授权。
PCT/US2012/059680对应的美国专利申请于2018年6月5日获得专利权(US9987428B2),US9987428B2保护一种包含具有壁的容器、塞子、密封组件、液体递送系统及致动器的注射器。
以US9987428B2为基础,Amgen在2016年又递交了4项延续案申请(US20160199578A1、US20160199582A1、US20160199583A1和US20160166765A1),均处于在审状态,尚未获得授权。
Evolocumab在中国的专利申请
目前,Amgen递交的多项PCT申请已经进入了中国国家阶段。在中国,与瑞百安®相关的专利申请包含结合PCSK9的抗原结合蛋白(CN101932607B)、抗PCSK9抗体的制药用途(CN103841992A)、抗PCSK9抗体制剂(CN104619340A)等。
其中保护活性成分的授权专利CN101932607B,其权利要求1对结合PCSK9的抗原结合蛋白的重链、轻链的CDR序列及其结合的PCSK9蛋白的序列进行了限定。
在CN101932607B的基础上,Amgen又递交了3件分案申请(CN104311666A、CN104311667A和CN104311665A),目前均处于在审状态,尚未获得授权。
由此可见,Amgen在中国正逐渐构建起围绕抗体活性成分的核心防御性专利族,同时也在储备制剂、制药用途等拓展性专利。
PCSK9生物抑制剂在中国的研发现状
目前,他汀类药物仍是治疗家族性高胆固醇血症的首选药物,占整体市场份额的80%以上。但部分高胆固醇血症患者对他汀类药物不耐受或家族性高胆固醇血症患者经他汀类药物治疗后LDL-C水平仍难以控制,PCSK9抑制剂的出现提供了一种新的降胆固醇的治疗模式。
国内的药企如恒瑞医药、信达生物、君实生物等亦在布局该靶点的药物。其中君实生物自主研发的重组人源化抗PCSK9单抗JS002,首先获得了CFDA核准颁发的药物临床试验批件,如果临床试验顺利,其可能成为第一个上市的国产大分子类PCSK9抑制剂。
据估计,中国约有4.5亿高胆固醇血症患者,期待国产PCSK9抑制剂的上市以满足国内高胆固醇患者的临床需求。不过,国内企业在产品上市前需密切关注Amgen等原研厂家在中国的专利申请情况并采取合适的行动,以降低不必要的风险。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
