β-地中海贫血的基因治疗
β-地中海贫血属于常染色体隐性遗传病,其编码β-珠蛋白的基因异常使β珠蛋白的合成减少或不能合成,α-珠蛋白大量积累,导致血红蛋白的组分改变,进而引发红细胞寿命缩短,临床上表现为慢性溶血性贫血。
基因治疗 (Gene Therapy)可将外源基因导入靶细胞,以纠正或补偿基因缺陷或基因表达异常引起的疾病。
地中海贫血的发病机制明确,纠正其缺陷的β珠蛋白基因即可根治疾病,因此是理想的基因治疗的疾病模型。
β-地中海贫血的基因治疗流程
β-地中海贫血的离体 (Ex Vivo)基因治疗过程主要包括:
收集病人的造血干细胞;
使用BB305将正常的β-珠蛋白基因导入其中,使细胞功能恢复正常;
将改造后的造血干细胞回输给病人。
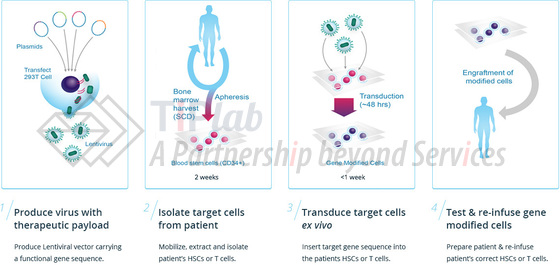
造血干细胞来源于病人自身,因此不存在配型和排斥的问题。改造后的造血干细胞进入病人体内后,会源源不断产生功能正常的新的红细胞,从而缓解甚至治愈疾病。
Bluebird的病毒载体系统
Bluebird (曾用名为Genetix Pharmaceuticals)是一家致力于开发严重遗传性疾病基因疗法的公司,其在研的BB305是一种携带有人β-珠蛋白基因的慢病毒载体。
BB305在针对β-地中海贫血的实验性治疗中显示出优于现有治疗药物的显著优势,并于2015年获得FDA的“突破性疗法”的称号。
然而,BB305的研发并不是一蹴而就的,而是研究人员对病毒载体基因组多次改造的结果。其中的里程碑事件分别是: 1984-1986年间鉴定出β-珠蛋白基因调控元件 (LCR); 1994年得到了整合有人β-珠蛋白基因表达盒的γ-逆转录病毒 (γ-RV) 1996年发现了慢病毒载体 (LV)。
在对病毒载体进行改造的过程中,Bluebird进行了大量的专利申请,同时也与Research Development Foundation (RDF)、Massachusetts Institute Of Technology (MIT)和Children’s Medical Center Corporation (CMCC)等第三方达成了相关专利的独占许可协议,构建了保护其载体系统有效的专利组合。
逆转录病毒载体(RV)
RV的转染谱广,可以实现外源基因的完全整合。Mulligan和Nienhuis实验室首先报道了含有人β-珠蛋白基因及其启动子的RV。
随后,MIT的Leboulch等将β-珠蛋白基因、β-珠蛋白基因启动子及其调控元件LCR反向放置,同时删除了β-珠蛋白基因第二个内含子中的重复基因,避免病毒粒子在包装前的剪切,得到了具有人β-珠蛋白基因盒稳定的γ-RV。
为了保护该修饰,MIT递交了多项专利申请,如已授权的美国专利US5631162A(现已许可给Bluebird),其权利要求1为:

涉及生产转导β-珠蛋白基因和β-LCR序列的RV的方法,使用权利要求1中限定的方法得到的载体具有稳定转染细胞系或小鼠骨髓细胞、病毒滴度达到有效感染骨髓细胞和β-珠蛋白基因高表达的特征。
目前,该专利已经届满失效。
慢病毒载体 (LV)
由于大多数的RV只能转导分裂的细胞,这就限制了其在非分裂的细胞如造血干细胞等中的用途。
1996年,研究人员发现了可以感染分裂和静止期细胞的LV。LV属于逆转录病毒属,具有病毒复制所需的基因rev和tat,辅助基因vif、vpr、vpu和nef及结构蛋白基因env等,基因组较γ-RV复杂,而且LV还具有转移基因片段容量大、不易诱发宿主免疫反应等优点。
1999年,Genetix Pharmaceuticals递交了涉及生产LV的细胞系的美国专利申请,目前已经获得授权,授权公告号为US6365150B1。 US6365150B1的权利要求1为:

涉及一种RV包装的细胞系,其第一载体包含RV的gag和一部分pol基因;第二载体包含与Vpr或Vpx基因融合的不在第一载体中RV的pol基因;第三载体包含env基因。
US6365150B1的从属权利要求2进一步限定了权利要求1中所述的逆转录病毒是慢病毒。
LentiGlobin BB305
2001年,Leboulch及其同事报道了使用LVs纠正镰刀型细胞贫血症 (SCD)的小鼠模型。SCD的致病机制是编码β-珠蛋白的基因发生了突变。
Leboulch等使用的LVs包含HIV的Rev反应元件 (RRE)、中央多嘌呤区 (entral polypurinetract)、人β-珠蛋白基因、人β-珠蛋白基因启动子和由HS2、HS3和HS4组成的mini-LCR。
为了准备人体的临床试验,Leboulch等对其LVs主要进行了三方面的安全性修饰:
其一是突变LV的GAG基因,删除3’LTR端U3区域内的病毒启动子和增强子,得到了self-inactivating (SIN)形式的LV,SIN修饰降低了载体对细胞原癌基因的激活;
其二是用源自兔β-珠蛋白基因的人工多聚腺苷酸/终止信号取代3’LTR的U5区,该修饰能够显著提高病毒的滴度;
其三是将两个250bp的鸡β-珠蛋白染色质绝缘子cHS4插入LV的U3区,避免宿主细胞因整合了β-珠蛋白基因导致的相邻基因的顺式激活,修饰后的载体被命名为HPV569。
2003年,Genetix Pharmaceuticals和MIT共同递交了多项专利申请对改造后的病毒载体进行了保护,如PCT/US2003/039526的延续案US7901671B2,其权利要求1为:

涉及一种SIN形式的HIV病毒载体。
另外,几项试验数据表明,HPV569的3’LTR端因存在cHS4绝缘子而导致其对造血干细胞的转导能力降低。于是Leboulch等删除了cHS4,并将HPV569载体5’LTR端野生型HIV-1 U3替换成了CMV启动子,最终得到了LentiGlobin BB305,该修饰降低了载体对包装质粒的需要并提高了载体的滴度。
目前,BB305针对β-地中海贫血的三期临床试验仍在进行,若试验顺利,将对现有的治疗市场产生重大的影响。
基因治疗大有可为
目前科学家们对人体基因功能与疾病发生机制的研究仍非常有限,故而当前的基因治疗只适用于少数致病机制非常明确的疾病。
转基因技术是基因治疗发展过程中最早出现的治疗方案,人工改造的病毒是目前基因治疗中最常用的载体,转基因+“离体”治疗方式在技术上相对较容易实现,而且“离体”方案更适用于血液细胞相关疾病的基因治疗。
综合疾病的致病机理,β-地中海贫血是非常理想的基因治疗适应症,待技术进一步成熟后,基因治疗有望在临床上得到迅速推广。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
