重磅单抗药物——Darzalex
Daratumumab是一种全人源IgG1κ 单克隆抗体,以高亲和力的方式特异性识别多发性骨髓瘤(Multiple myeloma,MM)恶性浆细胞上高表达的CD38,直接导致癌细胞调亡,还能通过抗体依赖性细胞介导的细胞毒性(ADCC)、补体依赖性细胞毒性(CDC)及抗体依赖性细胞吞噬作用(ADCP)快速杀死癌细胞。
早在1980年,哈佛医学院的E.L Reinherz和S. Schlossman等人在寻找T细胞受体过程中就发现了CD38,当时被称之为T10,现在我们知道CD38是一种具有调节淋巴细胞再循环和细胞内钙浓度等功能的II型跨膜糖蛋白。
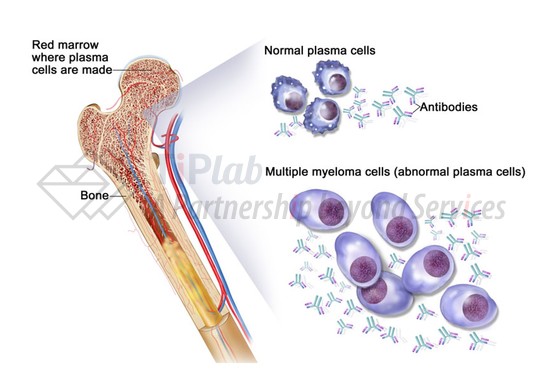
研究发现,CD38在MM患者恶性浆细胞中高表达,而在正常淋巴细胞、骨髓细胞及其它一些非造血组织细胞中的表达相对较低,因此CD38是治疗MM理想的靶点。
2003年,丹麦哥本哈根的Genmab公司开始研发CD38抗体,两年后daratumumab成为候选抗体。
上市后的daratumumab(Darzalex®)为一种无色至浅黄色注射剂,稀释后静脉输注。在上市后的第二年 (2017年),Darzalex®的销售额就高达12.42亿美元,成功跨入了重磅药的行列,预计未来5年总销售额将达到175亿美元。
“势如破竹”的审批历程
MM是一种浆细胞发生癌变的血液癌症,其治疗方法主要包括化疗、免疫调节药物(IMiDs,如来那度胺)和/或蛋白酶体抑制剂(PIs,如硼替佐米)联合或不联合干细胞移植,目前仍无法治愈。
2013年5月,因daratumumab在治性MM的临床试验中显示出良好的单药活性,获得了美国FDA快速通道指定(Fast Track Designation)和突破性疗法指定(Breakthrough Therapy Designation)。
2015年2月,Genmab宣布在daratumumab 16 mg / kg给药组中,患者的总体缓解率(ORR)为29.2%,同年6月Janssen启动向FDA滚动申报daratumumab的生物制品许可申请(BLA),9月FDA授予对daratumumab的优先审查。
2015年11月,FDA批准daratumumab单药治疗至少接受过三次既往治疗包括PIs和IMiDs或同时对PI与IMiDs耐药的MM患者,是第一个被美国FDA批准用于治疗MM的单抗药物,从申请到获批仅用了5个月。
随后在2016年5月和2017年9月,Darzalex®相继在欧洲和在日本获批上市,并被FDA和EMA授予治疗MM的孤儿药。
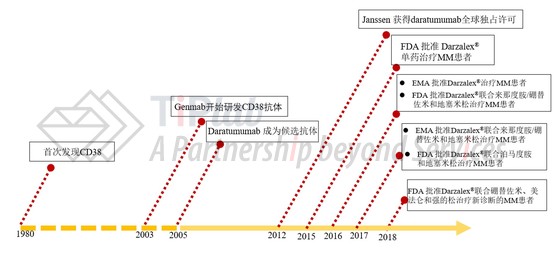
不仅如此,daratumumab联合用药的临床试验也显示了很好的结果,其联合用药的审批也一路绿灯,如2016年6月,Darzalex®联合来那度胺/硼替佐米和地塞米松的治疗方案再次获得FDA突破性疗法的指定,同年11月被FDA批准用于治疗经治性MM患者。
围绕Darzalex的专利壁垒
2012年,Janssen Biotech投资11亿美元从Genmab处获得了daratumumab的全球独占许可。目前daratumumab也是Janssen大力开发的一款抗肿瘤产品,自上市以来为Janssen和Genmab创造了巨大的经济效益,为保障其市场竞争优势,Janssen和Genmab围绕Darzalex®递交了大量的专利申请。
Genmab递交的活性成分专利家族
Genmab首先开发了daratumumab,2006年3月Genmab首先递交了保护活性成分的国际申请PCT/DK2006/000166,该申请进入了美国、欧洲、中国等国家,并先后在这些国家获得了授权。
在美国授权的专利——US7829673B2的权利要求1为:
“An isolated full-length antibody which binds to human CD38, wherein the antibody comprises a heavy chain variable region comprising the amino acid sequence set forth in SEQ ID NO:7 or encoded by the nucleotide sequence set forth in SEQ ID NO:6.”
限定了抗体重链与轻链可变区的氨基酸序列或编码这些氨基酸的核苷酸序列。
US7829673B2还保护了重链和轻链的CDR序列,如权利要求11为:
“An isolated full-length antibody which binds to human CD38, wherein the antibody comprises a heavy chain variable region comprising CDR1, CDR2, and CDR3 sequences comprising the amino acid sequences set forth in SEQ ID NOs: 8, 9, and 10, respectively, and a light chain variable region comprising CDR1, CDR2, and CDR3 sequences comprising the amino acid sequences set forth in SEQ ID NOs: 3, 4, and 5, respectively.”
通过序列比对可知,这些权利要求保护的范围均涵盖daratumumab,因此任何涉及相关序列的产品,都会落入其保护范围,为竞争对手设置了较大的障碍,US7829673B2将在2026年8月到期。
Genmab又递交了US7829673B2的一系列延续申请,如US9187565B2限定了抗体的抗原结合表位。
在中国获得授权的专利CN101218256B保护了抗体的重链和轻链,保护范围也涵盖daratumumab。
可见,Genmab充分利用继续申请和分案申请等形式,以不同的范围(包括抗体本身的序列和抗体结合的抗原表位等)对抗体进行了保护,构建起围绕活性成分的防御性专利家族,阻止技术跟随者和潜在竞争者,来保障自身的利益。
Janssen递交的联合用药专利家族
之后,Janssen发现daratumumab联合用药显示很好的治疗效果,并于2015年2月,递交了两个涉及联合用药的国际专利申请:PCT/US2015/017420和PCT/US2015/017425。
PCT/US2015/017420进入了美国国家阶段并获得了授权(US9603927B2),其权利要求1为:
A method of treating a subject having a CD38-positive hematological malignancy, comprising administering to the subject in need thereof an anti-CD38 antibody in combination with cyclophosphamide, doxorubicin, vincristine and prednisone (CHOP), wherein the anti-CD38 antibody comprises heavy chain complementarity determining region (HCDR) 1 (HCDR1), 2 (HCDR2) and 3 (HCDR3) sequences of SEQ ID NOs: 6, 7 and 8, respectively, and light chain complementarity determining region (LCDR) 1 (LCDR1), 2 (LCDR2) and 3 (LCDR3) sequences of SEQ ID NOs: 9, 10 and 11, respectively ,
US9603927B2保护使用抗体与环磷酰胺、阿霉素、长春新碱和强的松组合治疗CD38阳性血液恶性肿瘤患者的方法,并限定了抗体的重链和轻链CDR序列。US9603927B2的保护期直至2035年2月。
PCT/US2015/017425对应的美国授权专利US9732154B2的权利要求1为:
A method of treating a subject having acute lymphoblastic leukemia (ALL), comprising administering to the subject in need thereof an anti-CD38 antibody comprising heavy chain complementarity determining regions (HCDR) 1 (HCDR1), 2 (HCDR2) and 3 (HCDR3) sequences of SEQ ID NOs: 6, 7 and 8, respectively, and light chain complementarity determining regions (LCDR) 1 (LCDR1), 2 (LCDR2) and 3 (LCDR3) sequences of SEQ ID NOs: 9, 10 and 11, respectively, in combination with vincristine, wherein the subject is resistant or has acquired resistance to treatment with a BCR-ABL kinase inhibitor.
US9732154B2保护抗体的重链和轻链CDR序列及其联合长春新碱治疗急性淋巴细胞白血病患者,保护期直至2035年2月。
上述专利申请保护的联合用药方案与FDA批准的说明书中给药方案不完全一致,推测其后续可能会递交相关联合用药方案的上市申请。
优化制剂—皮下注射剂型
Darzalex®是通过静脉输注的方式给药,耗时较长,患者顺应性不好,为了解决这一问题,2015年初Janssen与Halozyme公司达成合作,开发daratumumab的皮下注射剂型。
Janssen在其皮下注射剂型中加入了透明质酸组分,可以增加药物的分散性,促进药物的吸收。
为了更好地保护这一剂型改进,Janssen于2016年11月递交了保护daratumumab的皮下注射剂型的国际专利申请PCT/US2016/059893,并进入了美国等国家。其美国专利申请US20170121414A1请求保护抗CD38的皮下注射剂,其包含1200 mg-1500 mg的抗CD38抗体和30000-45000 U的透明质酸等,该专利申请仍处于在审阶段,尚未获得授权。
研发与专利齐飞
从Genamab开始daratumumab的研发,到Janssen不断对其进行适应症拓展和剂型改进中,都积极围绕Darzalex®进行专利布局,牵制竞争对手产品的上市进程,为Darzalex®保驾护航。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
