Tafamidis两种剂型同时获FDA批准上市
2019年5月3日,辉瑞的tafamidis获得美国FDA批准,用于治疗野生型或遗传型甲状腺素运载蛋白淀粉样病变心肌病(ATTR-CM)成人患者。
获批的tafamidis为口服制剂,有两种形式:VYNDAQEL®(tafamidis meglumine)和VYNDAMAX®(tafamidis)。这意味着这两种药物成为了FDA批准的首创的(first-in-class)甲状腺素运载蛋白(TTR)稳定剂,也是首个获批的ATTR-CM药物。

TTR是一种四聚体形式的蛋白,解离成单体后会错误折叠为淀粉样物质,沉积于心肌间质,导致限制性心肌病和进行性心力衰竭,即ATTR心肌病(ATTR-CM)。Tafamidis能够以高亲和力、高选择性地结合TTR的甲状腺素结合位点,抑制TTR四聚体解离为单体。
在2012年,辉瑞就向FDA递交了tafamidis的新药申请,但FDA要求辉瑞“在批准之前建立有效的实质性证据”,所以tafamidis当时未能成功上市。
此次获批是基于一项关键性III期临床研究ATTR-ACT的数据。
在我国,tafamidis meglumine(商品名:维达全®)于今年2月5日获得国家药品监督管理局批准,用于治疗转甲状腺素蛋白淀粉样病变多发性神经病(ATTR-PN)I期症状性成人患者。
此外,tafamidis meglumine已在欧洲、日本等40多个国家和地区获批治疗ATTR。
Tafamidis两种剂型诞生了两款产品
Tafamidis是一种苯并噁唑衍生物,获批的有两种适于口服的药用形式。
一种商品名为VYNDAQEL®,活性成分为tafamidis葡甲胺盐,化学名称为2-(3,5-二氯苯基)-1,3-苯并恶唑-6-羧酸单(1-脱氧-1-甲基氨基-D-葡萄糖醇),分子量为503.33 g/mol。Tafamidis的葡甲胺盐化学式如下所示。
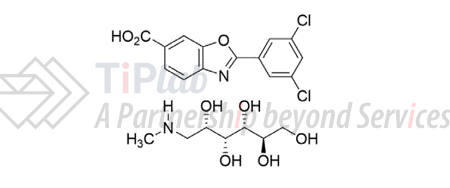
VYNDAQEL®为20mg的明胶软胶囊(相当于12.2mg的tafamidis游离酸),推荐剂量为80mg/天,即,4粒胶囊/天。
另一种名为VYNDAMAX®,活性成分为tafamidis的游离酸形式,分子量为308.12 g/mol,化学式如下所示。

VYNDAMAX®胶囊的规格为61mg,推荐剂量为61mg/天,以单个胶囊给药。
说明书中指出,80mg的VYNDAQEL®与61mg的VYNDAMAX®具有生物等效性。游离酸类型的tafamidis的开发,可能是为了方便患者服用,每日口服一粒胶囊即能达到推荐剂量。
围绕tadamidis的专利申请
Tafamidis最初主要由斯克里普斯研究所(The Scripps Research Institute)的Jeffery Kelly博士研发。2010年,辉瑞通过收购Jeffery Kelly教授创立的药物公司FoldRx将tafamidis收入囊中。
通过分子设计获得tafamidis
当时,已知能够结合TTR的化合物有二氟尼柳(2’,4’-二氟-4-羟基-[1,1’-联苯]-3-羧酸)、多氯联苯(PCB)等,但因为存在一些不期望的特性而无法成为治疗TTR淀粉样病变的药物。斯克里普斯研究所的研究人员在这些化合物结构的基础上,进行分子设计,改变了不期望的特性,如降低二氟尼柳的NSAID活性从而减少其副作用,或降低多氯联苯的毒性,最终获得了tafamidis分子。
斯克里普斯研究所于2003年12月19日递交了涉及tafamidis化合物的美国专利申请US10/741,649,并在此基础上衍生出诸多分案和延续案。
母案US7214695B2保护化合物通式
US10/741,649的授权专利为US7214695B2,其独立权利要求1涉及式I的通式化合物或其药学上可接受的盐,其中,式I中的Ar为3,5-二氟苯基、2,6-二氟苯基、3,5-二氯苯基、2,6-二氯苯基、2-(三氟甲基)苯基或3-(三氟甲基)苯基。保护范围涵盖tafamidis。
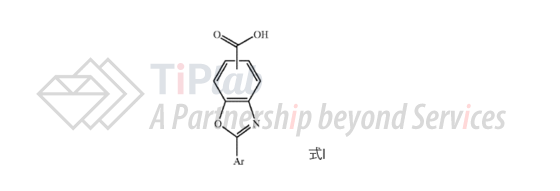
从属权利要求2进一步限定了式I中的具体化合物的结构,包括羧基在苯环上4种不同位置的取代,以及每种位置下选择上述6种不同的取代基Ar,共形成24种具体化合物。对竞争对手造成了有效的阻碍。
其他从属权利要求分别保护了包括tafamidis在内的其中4种具体化合物,以及分别包含4种具体化合物和药学上可接受载体的药物组合物,并限定所述组合物配制为单剂量给药。
US7214695B2及同族专利的说明书记载了能够降低甲状腺素运载蛋白四聚体解离的多种化合物,包括选自二氟尼柳类似物、多氯化联苯和苯并噁唑的化合物。以说明书原始记载的内容为基础,申请人先后递交了多份申请,以保护不同的产品或方法。
延续案US7214696B2保护医药用途
US7214695B2的延续案申请,授权专利号为US7214696B2,涉及tafamidis的医药用途。
US7214696B2的独立权利要求1涉及一种治疗甲状腺素运载蛋白淀粉样病变疾病的方法,所述方法包括向受试者施用有效量的式I的通式化合物及其药学上可接受的盐。
在化合物限定中,与母案的权利要求不同的是,US7214696B2的权利要求1中的式I中,除了母案提到的6种取代基以外,Ar还可以是苯基。因此,式I涵盖的具体化合物数量比母案多了一些,扩大为28种。相应的,从属权利要求对这28种具体化合物的治病方法分别进行了保护。
此外,其他从属权利要求对适应症进行了进一步限定,分别为家族性淀粉样多发性神经病(FAP)、家族性淀粉样病变心肌病(FAC)、老年性系统性淀粉样病变(SSA),或肝移植后出现的心脏淀粉样病变。
延续案US8168663B2保护tafamidis可药用盐
延续案US8168663B2涉及tafamidis的药学上可接受的盐。US8168663B2的权利要求2限定所述可药用盐为一种N-甲基-D-葡糖胺盐,即VYNDAQEL®的药用形式tafamidis meglumine。
有意思的是,US8168663B2的母案之一US7560488B2并未涉及tafamidis,而是保护了已知产品的新用途,并用施用方式和剂量的特征与现有技术进行区别。具体来说,其权利要求1保护了二氟尼柳治疗甲状腺素运载蛋白淀粉样病变疾病的方法,包括一天两次口服250mg的二氟尼柳。
分案US8653119B2保护可药用盐的治疗用途
2011年11月22日,申请人又递交了US8168663B2的分案申请,授权号为US8653119B2。该分案保护了tafamidis的可药用盐治疗甲状腺素淀粉样病变疾病的方法。相应的,从属权利要求限定该可药用盐为tafamidis的N-甲基-D-葡糖胺盐。
同样是治疗用途权利要求,US8653119B2与US7214696B2在适应症种类方面是相同的,从属权利要求分别保护了tafamidis的可药用盐治疗FAP、FAC、SSA,或肝移植后出现的心脏淀粉样病变的方法。
晶型专利家族—涉及tafamidis葡甲胺和游离酸结晶
Tafatimidis的晶型专利由辉瑞递交,分别保护了tafamidis两种形式的晶型。
PCT专利申请PCT/IB2012/054748于2012年9月12日递交,涉及tafamidis葡甲胺晶型。该PCT申请进入美国国家阶段的授权专利为US9249112B2,权利要求1使用粉末X射线衍射图谱对晶型进行了限定。

涉及tafamidis游离酸结晶固体形式的申请PCT/IB2015/056597于2015年8月31日递交,进入美国的授权专利为US9770441B1。它的权利要求1使用选自固态NMR图谱、粉末X射线衍射图谱和拉曼图谱的分析参数限定保护范围,如下:

双管齐下的专利申请策略
在这个案例中,tafamidis两种剂型在美国同时获批上市,这两个产品的核心结构相同,只是盐型不同,因此,其大部分专利家族通常能够同时涵盖两种产品,然后再针对每个产品的不同点进行分别保护,达到双管齐下的效果。
可以看到,围绕tadamidis的专利申请呈现从宽泛到精准趋势:首先保护了核心通式结构的化合物结构和用途,接着精准保护了tadamidis的可药用盐及其治疗用途,这些均涵盖两种已获批的产品的结构和用途,然后先后针对获得了针对tafamidis葡甲胺和游离酸晶形式递交了专利申请,在一定程度上延长了tafamidis产品线的生命周期。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
