#漫威英雄带你了解炎症性肠病
武田 (Takeda)与漫威 (Marvel)公司合作推出了超级英雄漫画—The Unbeatables,漫画中的3位超级英雄都患有炎症性肠病 (Inflammatory Bowel Disease,IBD),IBD是一种特发性肠道炎症性疾病,主要包括克罗恩氏病 (Crohn’s disease,CD)和溃疡性结肠炎 (Ulcerative colitis,UC),会造成腹痛、呕吐和腹泻等症状,除此之外,IBD还会为患者带来日常生活和人际关系方面的困扰,武田希望通过英雄漫画促使人们更加了解IBD,并鼓励IBD患者克服疾病带来的病痛和焦虑。

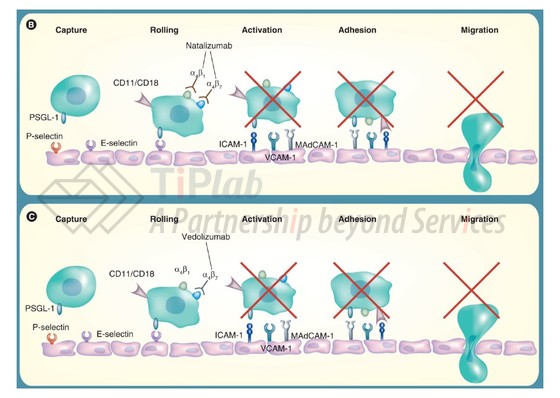
Entyvio® (活性成分:Vedolizumab)正是用来治疗IBD的一种人源化IgG1单克隆抗体,能够结合淋巴细胞表面表达的α4β7整合素。T淋巴细胞依靠α4β7整合素与肠内皮细胞表达的黏膜地址素细胞黏附分子 (MAdCAM-1)相互作用从而归巢至肠淋巴组织。Vedolizumab通过阻断α4β7/MAdCAM-1相互作用以抑制T淋巴细胞穿过内皮细胞迁移至发炎的胃肠组织。
20世纪80年代,麻省总医院的科学家们开发了一种能够结合α4β7整合素的鼠源抗体Act-1,并证实Act-1能够与α4β7结合,从而抑制与IBD疾病相关的α4β7/MAdCAM-1相互作用。随后Act-1被许可给了Millennium Pharmaceuticals公司以进行后续开发。
与此同时,LeukoSite也意识到Act-1治疗IBD的潜在价值,并在一个IBD动物模型中证实了Act-1可以消除腹泻和结肠炎症。当取得了这一关键性研究结果后,LeukoSite于1997年底与Genentech达成合作,共同开发靶向α4β7的人源化抗体LDP-02 (即为人源化的Act-1,vedolizumab)。LeukoSite是由整合素最早的发现人之一,哈佛大学医学院的Timothy A. Springer于1993年联合创办。1999年10月,LeukoSite被Millennium收购。随后在两项治疗中度UC和CD的二期临床试验中,与安慰剂对照组相比,vedolizumab显示出具有统计学意义的临床缓解率。2008年,武田通过收购Millennium获得了vedolizumab。
同为整合素抗体,vedolizumab与natalizumab (Tysabri®)的不同之处在于,natalizumab通过结合α4亚基同时抑制α4β7/MAdCAM-1和α4β1/VCAM-1的相互作用,而vedolizumab只特异性结合α4β7,而不结合α4β1整合素。抑制α4β1与VCAM-1结合可能会导致中枢神经系统内免疫监视能力下降,从而增加了罹患进行性多灶性白质脑病 (PML)的风险,这也是natalizumab遭受撤市风波的原因,并限制了natalizumab的广泛使用。目前的临床试验结果并未发现vedolizumab会导致PML等副作用,说明vedolizumab在安全性上更具优势,不过其长期安全性还需要持续监测。
2014年,vedolizumab获得FDA批准,以商品名Entyvio®进行销售,用于治疗对TNF抑制剂、免疫调节剂或皮质类固醇等药物响应不足的中重度UC和CD,剂型为静脉注射剂型。2016年,Entyvio®的销售额就已经达到13.2亿美元,成为武田最畅销的药物之一,得益于其副作用较低,可能很快将赶超2004年就已获批的Tysabri®。武田还在开发vedolizumab的皮下注射剂型,目前正在美国、欧洲和日本进行临床三期试验,此外,武田还在进行vedolizumab治疗类固醇难治性移植物抗宿主病的临床二期试验。
保护vedolizumab的专利
1996年,Millennium递交了保护vedolizumab的核心专利并获得了授权 (US7147851B1),权利要求1保护:
“A humanized immunoglobulin or antigen-binding fragment thereof having binding specificity for α4β7 integrin comprising a heavy chain and a light chain, wherein said heavy chain comprises the variable region of SEQ ID NO:19 and said light chain comprises the variable region of SEQ ID NO:21.”
US7147851B1的权利要求1保护一种结合α4β7的人源化抗体,并限定抗体的重链和轻链包含如序列19和序列21中的可变区,是常见的“抗体结构+功能性限定”类型的权利要求,US7147851B1已经于2017年7月到期。获得授权的同族中国专利CN100406562C的保护范围略宽,权利要求1保护:
“一种选择性地结合α4β7整合蛋白的人化免疫球蛋白或其抗原 结合片段,所述的人化免疫球蛋白或抗原结合片段包括非人源互补决定区 (CDRs)和由人源重链和轻链衍生而来的重链和轻链框架区。”
可见,CN100406562C并没有对抗体的序列进行具体限定,而仅限定了抗体CDR区和FR区的来源。CN100406562C也已经于2017年到期。
接着,Millennium递交了US7147851B1的分案申请并获得了授权 (US7402410B2),保护编码US7147851B1中抗体的核酸序列,US7402410B2已经于2016年8月到期。
除了保护抗体活性成分的专利外,Millennium还获得了保护治疗方法的专利,比如US6551593B1的权利要求1保护:
“A method for treating an individual having a disease associated with leukocyte recruitment to the gastrointestinal tract or other tissues as a result of binding of leukocytes to gut-associated endothelium expressing the molecule MAdCAM, comprising administering to the individual an effective amount of an antibody or antigen binding fragment thereof, said antibody or fragment having the epitopic specificity of the ACT-1 monoclonal antibody.”
US6551593B1的权利要求1保护使用抗体治疗白细胞募集至胃肠道或其它组织相关疾病的一种方法,并且仅限定抗体具有ACT-1单抗的表位特异性。不过US6551593B1已经于2015年2月到期。
Vedolizumab的研发历史可追溯至上世纪80年代,而早期保护活性成分和治疗方法的专利也大都于上世纪90年代递交,因此这些专利都已陆续到期。
为了保持市场竞争优势,Millennium在近几年又递交了一些新的专利申请,比如,保护治疗用途的US9663579B2,其权利要求1保护:
“A method for achieving clinical response of Crohn’s disease in a human patient, comprising intravenously administering to a human patient with Crohn’s disease, wherein said human patient had a lack of an adequate response with, lost response to, or was intolerant to a TNFα antagonist: a first dose of 300 mg of an antibody that has binding specificity for human α4β7 integrin…. and a third dose of 300 mg of the antibody…., wherein the antibody comprises the heavy chain variable region sequence of amino acids 20 to 140 of SEQ ID NO:2, and the light chain variable region sequence of amino acids 20 to 131 of SEQ ID NO:4.”
US9663579B2的权利要求1保护治疗对于TNFα抑制剂响应不足的克罗恩氏病的一种方法,包括静脉注射靶向α4β7的抗体,具体限定了注射的剂量和时间点,以及抗体的重链和轻链可变区。权利要求中限定的给药剂量和时间点与FDA批准的药品说明书中的内容一致。US9663579B2于2017年刚获得授权,预计将至2032年到期。
Millennium还递交了保护抗体制剂的专利,比如,US9764033B2保护抗α4β7抗体的冻干制剂,将于2033年到期。同族的中国专利也获得了授权 (CN103608071B),将于2032年到期。
在此期间,Millennium还在尝试开发治疗IBD的新型药物并递交了专利申请,比如,US6274556B1保护一种结合α4β7的模拟多肽序列。
作用于整合素的药物研发值得关注
除了整合素类药物外,目前市面上还有其它一些治疗CD或UC的药物,比如:皮质类固醇、免疫抑制剂和TNF抑制剂等,不过仍存在一些局限性:比如皮质类固醇具有严重的副作用,而如adalimumab或infliximab等TNF类单抗也存在价格昂贵或治疗不响应的情况。作用于整合素的药物为IBD患者提供了一种新的选择,此外还有多个靶向整合素的抗体和小分子类在研药物:比如靶向β7的人源化抗体etrolizumab (Genentech)已经进入了临床三期试验阶段,靶向α4的小分子药物AJM-300 (Ajinomoto)和HMR-1031 (Aventis Pharmaceuticals)也陆续进入了临床实验阶段。对于IBD这种慢性病来说,市场需求会一直在,何况整合素家族与多种自身免疫疾病和慢性炎症疾病都相关,Entyvio®的市场表现已经证实靶向整合素类药物的巨大潜力,期待未来会有更安全有效的药物问世。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
