Erdafitinib加速获批上市
Erdafitinib最初由Astex Therapeutics公司研发。2008年Astex与强生(Johnson&Johnson)的杨森制药(Janssen)达成协议,共同研发推广抗癌新药。根据协议规定,强生公司获得了Astex的FGFR抑制剂计划下所有化合物的全球独占权,其中包括erdafitinib。
获批上市的药物商品名为Balversa®,用于治疗携带FGFR3或FGFR2易感基因突变、并且接受至少一种含铂化疗期间或之后(包括新辅助或辅助含铂化疗12个月内)病情进展的局部晚期或转移性尿路膀胱癌的成年患者。
酪氨酸激酶FGFR的激活变异、扩增、易位、融合等基因异常通常会导致下游通路过度活跃而造成肿瘤发生。作为FDA批准的第一款FGFR抑制剂,erdafitinib能够结合并抑制FGFR1、FGFR2、FGFR3及FGFR4的活性,在表达FGFR基因异常的细胞系中抑制FGFR磷酸化和信号传导,从而降低肿瘤细胞活力。
Erdafitinib在2018年被授予突破性药物资格(BTD)。最终获批是基于一项Ⅱ期临床试验结果,erdatfitinib对有靶向位点突变的病人治疗效果好于化疗和免疫治疗,因此获得加速批准。同时获批的还有Qiagen开发的一款伴随诊断器械,用于检测FGFR2和FGFR3的突变。

Erdafitinib活性成分
Erdafitinib的化学名称为N-(3,5-二甲氧基苯基)-N’-(1-甲基乙基)-N-[3-(1-甲基-1H-吡唑-4-基)喹喔啉-6-基]乙烷-1,2-二胺,分子式为C25H30N6O2,化学结构式如下。
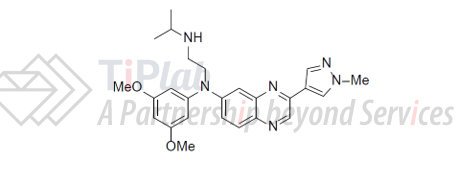
获批上市的erdafitinib为片剂形式,有3mg、4mg和5mg三种规格。规格较小,说明药物活性较高。
此外,片剂中还含有交联羧甲基纤维素钠、硬脂酸镁(来自植物来源)、甘露醇、葡甲胺和微晶纤维素。
围绕erdafitinib的专利申请
活性成分专利获得较大的保护范围
Erdafitinib的活性成分专利最早在2011年4月28日申请,Astex Therapeutics递交了PCT/GB2011/050851,进入了US、EP、JP和CN等三十多个国家和地区。
US8895601B2保护产品
PCT/GB2011/050851进入美国国家阶段的专利申请于2014年11月获得授权,公告号为US8895601B2。US8895601B2的独立权利要求1保护范围涵盖下式I的通式化合物,以及其互变异构形式、立体化学异构和同位素形式,或其氮氧化物、药学上可接受的盐或其溶剂化物。
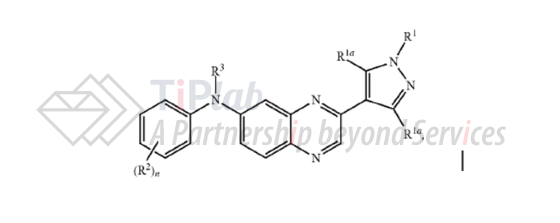
根据权利要求1,取代基R1、R1a、R2和R3结构的限制较小,选择的范围较大,种类较多,几乎包含了常见的碳氢基、碳氧基、碳氮基,以及其他多种含硫或卤素的取代基。
然后从属权利要求26、27和28保护了3种具体化合物,包括erdafitinib本身和两种衍生物。
US8895601B2的实施例中检测了制备得到的上百种化合物的生物活性,结果显示这些化合物对酪氨酸激酶的抑制活性差异不大,尤其是对FGFR1、FGFR2和FGFR3具有较好的抑制活性,大部分化合物的IC50均在10nM以下。这说明只要保持共有的核心结构不变,取代基的变化并不会对化合物的生物活性造成显著的影响。
这些足够数量的实验数据为权利要求1获得一个大的保护范围提供了支持。可以说,权利要求1画了一个大圈,有效地将竞争对手阻挡在外。
US8895601B2分案保护方法
2014年10月2日,Astex Therapeutics递交了US8895601B2的分案申请,授权专利为US9464071B2。独立权利要求1涉及一种治疗患有由FGFR激酶引起的疾病或病症的受试者的方法,所述方法包括向所述受试者施用式I的通式化合物,以及其互变异构形式、立体化学异构和同位素形式,或其药学上可接受的盐或其溶剂化物。
独立权利要求18则涉及式I化合物治疗癌症的方法,其他从属权利要求对癌症进行进一步限定,如为膀胱癌、肺癌、前列腺癌、乳腺癌等。从治疗范围来看,erdafitinib可以针对不同类型的肿瘤,潜在的治疗适应症是多样化的。
US8895601B2的中国同族
PCT/GB2011/050851进入中国国家阶段的授权专利为CN102858765B,独立权利要求1同样涉及式I的通式化合物。
同族美国专利US8895601B2只有产品权利要求,而用分案的方式对治病方法权利要求进行了保护。与之不同的是,CN102858765B的权利要求24还保护了制备式I化合物的方法,权利要求27则保护了式I的化合物用于制备预防或治疗癌症的药物的用途。
US9902714B2保护衍生物
2015年3月26日,Astex Therapeutics又递交了涉及erdafitinib衍生物的专利申请PCT/EP2015/056507,相应的美国专利的授权公告号为US9902714B2。
US9902714B2的独立权利要求1涉及式II的通式化合物,以及其互变异构形式、立体化学异构和同位素形式,或其药学上可接受的盐或其溶剂化物。

式II的化合物由包含erdafitinib的式I化合物与甲醛在合适的溶剂和合适的温度下反应得到,并且独立权利要求20对这一反应过程进行了保护。
根据实施例的描述,由式I的化合物得到式II的化合物并不难,将式I的化合物与甲醛在二恶烷、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺的存在下在室温下搅拌回流3天,或将式I的化合物与甲醇在大鼠肝脏提取物中共同孵育60min,即可得到式II的化合物。
且体外试验显示式II的化合物也具有一定的酪氨酸激酶抑制活性。不管这些衍生物是否会成为上市产品,都为竞争对手设置了更多的障碍。
制剂专利的技术方案克服化学稳定性问题
2016年2月9日,ASTEX THERAPEUTICS递交了PCT申请PCT/EP2016/052743,权利要求1涉及甲醛清除剂在药物组合物中的用途,所述用途是,增加包含在该药物组合物中的erdafitinib、其药学上的盐或其溶剂合物的化学稳定性。
申请文件中进一步解释了erdafitinib在甲醛存在的环境中不稳定,容易转化为副产物,而副产物就是上述式II所涵盖的化合物。甲醛清除剂能够阻止、延迟、减慢或减少erdafitinib向副产物的转化,且甲醛清除剂可以是葡甲胺。因此,上市的erdafitinib片剂形式中含有葡甲胺。这说明,US9902714B2中涉及的式II的化合物是不期望在药物中存在的成分。
目前,PCT/EP2016/052743进入美国国家阶段和中国国家阶段的专利申请正在审查中。
多种类型的专利家族共同阻挡竞争对手
ASTEX THERAPEUTICS首先提交了erdafitinib的活性成分专利,涵盖了多种取代基的衍生物,获得了一个较大的保护范围。并用分案的形式保护了活性成分治疗疾病的方法。此外,对于活性成分容易转化而成的副产物,以及如何避免这种转化反应,也申请了专利进行保护。围绕erdafitinib的多种专利家族共同灵活有效地阻挡了竞争对手。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
