Lorlatinib获批为NSCLC患者带来新希望
间变性淋巴瘤激酶(Anaplastic Lymphoma Kinase,ALK)是一种受体酪氨酸激酶,在多种肿瘤细胞中高表达,因此是一个极具吸引力的癌症治疗靶点。
辉瑞先后研发了第一代ALK抑制剂克唑替尼(crizotinib)和第二代ALK抑制剂塞瑞替尼(ceritinib)、Brigatinib。
不幸的是,获得性耐药突变的产生使病情进展的肿瘤患者的后续治疗药物选择变得有限。在ALK阳性转移性非小细胞肺癌(NSCLC)的治疗中,由于耐药性,几乎所有患者的肿瘤仍然会复发,其中相当大比例的患者发展为新的甚至更严重的脑转移。
于是,第三代ALK抑制剂lorlatinib应运而生。
Lorlatinib(商品名:LORBRENA®)是一种口服的具有抗ALK和ROS1体外活性的酪氨酸激酶抑制剂(TKI),对ALK、ROS1,以及TYK1、FER、FPS、TRKA、TRKB、TRKC、FAK、FAK2和ACK具有体外抑制活性。ROS1和ALK的遗传改变有利于肿瘤细胞的增殖和存活,也是NSCLC发展的关键驱动因素。Lorlatinib的施用能抑制激酶活性,破坏ALK和ROS1介导的信号转导,从而抑制ALK和ROS1过表达的肿瘤细胞的生长。
作为全新一代的ALK抑制剂,lorlatinib的优势在于,患者在接受了多种其它ALK抑制剂治疗产生耐药后,lorlatinib还可能有效。lorlatinib还具有较强的穿透血脑屏障的能力,可大大延长患者的生存期。
2018年11月2日,美国食品药品监督管理局(FDA)批准lorlatinib用于治疗在接受克唑替尼(以及至少其它一种ALK抑制剂)后病情仍进展,或在接受阿来替尼或塞瑞替尼作为第一个ALK抑制剂治疗后病情仍进展的ALK阳性转移性非小细胞肺癌(NSCLC)患者。
这次批准是基于一项非随机、多剂量的和活性评估的多队列、多中心1/2 期研究(B7461001),旨在评估lorlatinib用于ALK阳性转移性非小细胞肺癌患者的治疗,这些患者曾接受一种或多种ALK-TKI的治疗。
总共215位ALK阳性转移性非小细胞肺癌患者入组,并根据原先接受的不同治疗而分为不同的亚组。在这些患者中,总缓解率(ORR)为48%(95% CI:42%,55%);重要的是,57%的患者曾接受过一种以上ALK-TKI治疗。试验中,69%的患者有脑转移史,颅内缓解率为60%(95% CI:49%,70%)。
在此之前,lorlatinib被FDA授予孤儿药(orphan drug)的认定,还获得NSCLC突破性疗法资格和优先审评的待遇。
Lorlatinib的获批,为接受第二代ALK抑制剂治疗后病情进展的肿瘤患者提供了一种新方案,并为继续口服治疗提供了机会。
Lorlatinib活性成分
Lorlatinib的分子式为C21H19FN6O2(无水),分子量为406.41 Dalton。化学名称为(10R)-7-amino-12-fluoro-2,10,16-trimethyl-15-oxo-10,15,16,17-tetrahydro-2H-4,8-methenopyrazolo[4,3-h][2,5,11] benzoxadiazacyclotetradecine-3-carbonitrile,化学结构如下:

Lorlatinib制剂
FDA批准的lorlatinib制剂以25 mg和100 mg 两种规格的片剂形式提供,含有以下非活性成分:微晶纤维素、无水磷酸氢钙、羟基乙酸淀粉钠和硬脂酸镁。
围绕lorlatinib的专利申请
活性成分专利家族
2013年2月和3月,辉瑞先后分别递交了涉及活性成分的PCT专利申请(PCT/IB2013/051391)和美国专利申请(授权公告号:US8680111B2),要求了两个美国临时申请的优先权。 US8680111B2的权利要求1保护如下结构式V的化合物或其药学上可接受的盐,保护范围涵盖lorlatinib。
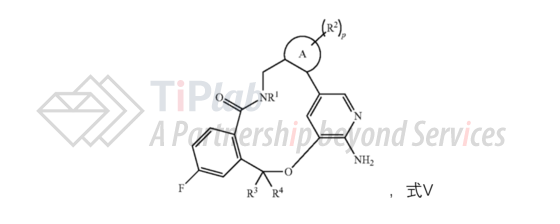
PCT/IB2013/051391进入了包括EP、JP、CN等多个国家或地区,其中进入中国国家阶段的授权专利为CN104169286B。权利要求1同样涉及通式为式V的化合物或其药学上可接受的盐,但是从取代基的限定来看,其保护范围比同族的美国专利稍小一些。其独立权利要求6还涉及了化合物或其药学上可接受的盐在制造用于治疗癌症的药剂中的用途。
以US8680111B2为母案,辉瑞提出了延续案,授权公告号US9133215B2,权利要求中所涉及的化合物通式VI与lorlatinib略有不同,与V相比,式VI中的吡啶环变为哌嗪环,不涵盖lorlatinib。
在不考虑专利期调整等因素时,US8680111B2和US9133215B2的专利保护期至2033年3月期满,相应中国专利CN104169286B的专利期至2033年2月期满。
晶型专利家族
在活性成分家族之后,辉瑞还递交了多个涉及lorlatinib晶型的专利家族。比如:
2014年6月,辉瑞递交了PCT专利申请(PCT/IB2014/062296),进入美国国家阶段的授权专利为US9637500B2,独立权利要求1涉及活性成分的结晶乙酸溶剂化物,并用粉末X射线衍射图谱对晶型进行限定。 PCT/IB2014/062296目前没有相应的中国专利。
为了改善晶型的物理稳定性,辉瑞开发了lorlatinib游离碱的结晶形式,并于2016年7月,递交了国际申请PCT/IB2016/054483,涉及lorlatinib游离碱的一种新的结晶形式(形式7),或用于治疗哺乳动物异常细胞生长引起的疾病或病症的方法,目前在多个国家阶段(包括US、CN、EP)处于审查状态。
PCT/IB2016/054483进入美国国家阶段的专利申请为US20180235933A1,其独立权利要求1用粉末X射线衍射图谱对lorlatinib游离碱的结晶形式进行限定,三个并列独立权利要求分别用拉曼光谱、13C NMR和19F NMR对晶型进行限定。
PCT/IB2016/054483进入中国国家阶段的专利申请为CN107849060A,独立权利要求1也使用粉末X射线衍射图谱对lorlatinib游离碱的结晶形式进行限定,限定范围与US2018/0235933A1不同。
辉瑞持续优化药物晶型,于2018年10月,又递交了国际申请PCT/IB2018/057735,涉及lorlatinib游离碱水合物的新的结晶形式(形式24),该国际申请尚未进入各国国家阶段。
辉瑞在不断优化lorlatinib晶型的同时,也在不断扩大其晶型专利家族。这些晶型专利家族不仅可以全方位阻挡竞争对手,还为以后可能开发更新版本的药物做准备。
联合用药专利家族
为了扩大药物使用范围,辉瑞也在进行lorlatinib与其他药物的联合用药研究,并于2016年与默克共同递交了PCT申请(PCT/US2016/053939),涉及一种PD-1轴结合拮抗剂和ALK抑制剂的联合用药治疗ALK阴性癌症的方法。但2018年公布的II期临床数据显示,在ALK阴性NSCLC患者中,lorlatinib与PD-L1 抑制剂avelumab的联合施用效果并没有优于lorlatinib单独施用效果。
结语
发明专利的保护主题分为产品和方法两类,前者的保护力度通常大于后者。
在研发早期,往往优先申请产品类型的权利要求,例如涉及化合物、化合物的盐、晶体、制剂和组合物等,随着研发的进展,还需要针对适应症、给药方案、联合用药等技术方案申请方法类权利要求以构建专利网络,对其进行保护。
因此,对于研发型企业而言,完善有效的专利保护如同企业的舵手,利用充分有效的专利保护其产品是企业最有利的武器。
* 以上文字仅为促进讨论与交流,不构成法律意见或咨询建议。
